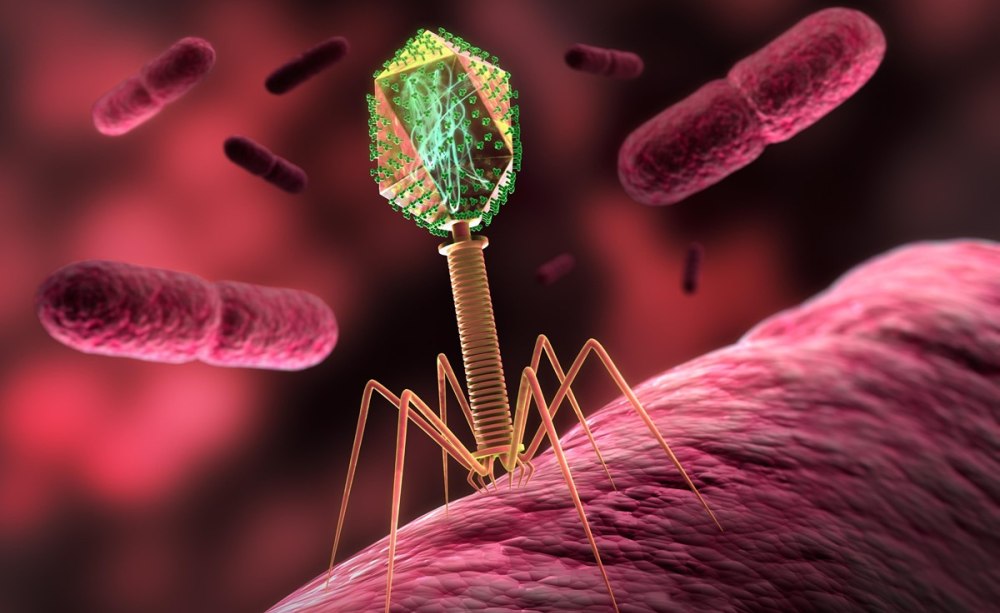
Bakteriophagen (hier in schematischer Darstellung) können eine Gefahr für die orale Gesundheit sein – in anderen Fällen aber auch von Vorteil sein.
Bakterien und Viren: DDr. Christa Eder über Besonderheiten der Koexistenz von Phagen und Mikroorganismen (1)
Das Mikrobiom der Mundhöhle umfasst mehr als sechs Billionen Mikroorganismen, darunter 800 Bakterienspezies und mehr als 100 verschiedene Pilzarten. Die qualitative und quantitative Zusammensetzung dieser Biozönose sowie deren Interaktion mit dem Immunsystem sind dabei entscheidend für Gesundheit oder Krankheit oraler Gewebe.
Neben dem oralen Mikrobiom findet sich analog dazu ein mindestens ebenso komplexes Virom mit 35-mal mehr potenziellen Erregern, sowohl im Speichel als auch auf den Hart- und Weichgeweben der Mundhöhle. Vor allem Viren der Herpesgruppe kennt man als Auslöser und Betreiber oraler Läsionen, wie etwa der Gingivostomatitis herpetica.
Dennoch ist die Rolle von Viren bei Entzündungen wie Stomatitis und Parodontitis bisher nur teilweise geklärt und Gegenstand zahlreicher Untersuchungen. Genetische Analysen haben gezeigt, dass Phagen den größten Anteil am oralen Virom haben. Diese zeigen sowohl Aktivität gegen planktonisch lebende Bakterien im Speichel als auch gegen die Keime in organisierten Biofilmen.
Lytischer Phagenzyklus reduziert Zahl potenziell pathogener Keime
Die Koexistenz von Phagen und Miroorganismen kann für die orale Gesundheit ein Vorteil sein – in anderen Fällen aber auch zur Gefahr werden. Die Ursache liegt im Mechanismus der Vermehrungszyklen der Bakteriophagen. Da Viren keinen eigenen Stoffwechsel haben, benötigen sie zu ihrer Replikation einen Wirtsorganismus. Im Fall der Phagen sind dies nicht die Zellen und Gewebe der Mundhöhle, sondern vielmehr die dort siedelnden Bakterien.
In vielen Fällen läuft die Vermehrung von Phagen über mehrere Phasen, nämlich die Anheftung an bakteriellen Zellwandrezeptoren, die Einbringung der Phagen-Nukleinsäure in das Bakterium, die anschließende Replikation des Phagengenoms und die Herstellung sämtlicher Hüllproteine und weiterer Bestandteile durch die Wirtszelle. Die neuen Phagen werden zusammengebaut und schließlich durch Platzen des befallenen Bakteriums freigesetzt. Dieses Vermehrungsschema wird als „lytischer Zyklus“ bezeichnet und endet immer mit dem Tod der Bakterienzelle, ein Vorgang, der für die Eliminierung möglicher bakterieller Pathogene in der Mundhöhle durchaus vorteilhaft sein kann und im Hinblick auf eine mögliche Phagentherapie in Teil 2 dieses Beitrags noch diskutiert wird.
Phagen modifizieren das orale Mikrobiom
Allerdings kann die „Infektion“ der Bakterien auch über einen anderen Weg ablaufen. Bei den sogenannten „temperenten Phagen“ ist nämlich auch ein lysogener Vermehrungszyklus möglich. Bei diesem wird die Nukleinsäure des Phagen in das bakterielle Genom oder in ein ringförmiges Plasmid (Replikon) zumindest vorübergehend eingebaut, ohne dem Wirt dabei zu schaden. Bei jeder Teilung des Bakteriums wird dann auch die Phagennukleinsäure repliziert. Damit entsteht eine Art von Kommensalismus zwischen Mikroorganismus und Virus, von dem das Bakterium unter gewissen Umständen sogar profitiert. So können Informationen zum Aufbau einer Resistenz gegen antibakterielle Wirkstoffe und auch andere Eigenschaften, die potenziell pathogenen Mikroorganismen einen Überlebensvorteil bringen, in das bakterielle Erbgut integriert werden.
Großes genetisches Potenzial
Diese Interaktion zwischen zellulären Mikroorganismen und Viren nimmt Einfluss auf die Zusammensetzung des oralen Mikrobioms. Die Phagenpopulation im Sulkusfluid und in den subgingivalen Biofilmen beinhaltet in jedem Fall ein nicht zu unterschätzendes genetisches Potenzial und ist ein wesentlicher Faktor für die Diversität oraler Ökosysteme. Das Virom der Mundhöhle zeigt typische Verteilungsmuster der unterschiedlichen Phagenarten in Abhängigkeit vom jeweiligen Habitat. So findet man bestimmte Spezies bevorzugt im Speichel, andere sind mit oralen Biofilmen assoziiert. Untersuchungen haben auch typische Wirt-Virus-Paarungen für einige Bakteriengattungen wie Streptococcus und Veilonella mit definierten Phagen gezeigt, während es etwa für Actinomyces keine derartigen Übereinstimmungen gab.
Rolle der Phagen im Entzündungsgeschehen unklar
Inwieweit sich die Phagen selbst als unterstützende Faktoren am Entzündungsgeschehen beteiligen und ob sie mitverantwortlich für die Dysbiose und die Verschiebung des ökologischen Gleichgewichts in der oralen Mikroflora sind, ist Gegenstand zahlreicher wissenschaftlicher Untersuchungen. Fest steht, dass sich das Virom in den Biofilmen der Mundhöhle in Abhängigkeit vom Schweregrad einer entzündlichen Erkrankung deutlich in seiner Zusammensetzung verändert. Das Virom des Speichels hingegen zeigt eine weitaus geringere Variabilität.
Gentransfer durch Phagen kann Antibiotikaresistenzen fördern
Phagen sind in der Lage, ihre Gene horizontal auszutauschen. Damit besteht die Möglichkeit der Funktion als Vektoren, die sich an der über Artgrenzen hinausgehenden Verbreitung von Antibiotikaresistenzen zwischen pathogenen Bakterien beteiligen. Noch fehlt einiges an Wissen und Information über die Genexpression von Phagen in „gesunden“ und „krankmachenden“ Viromen, aber es mehren sich die Hinweise für derartige bedenkliche Übertragungsmechanismen.
Progressionsbeschleuniger der Parodontitis
Für Aggregatibacter actinomycetemcomitans wurde bei Präsenz eines bestimmten Phagentyps eine deutliche Steigerung der Virulenz, einhergehend mit einer massiven Progression der Parodontitis beschrieben. Die Anwesenheit dieses Virus ist mit multipler Antibiotikaresistenz und der Induktion erhöhter Leukotoxinfreisetzung assoziiert.
Phagen eher auf atypischer Bakterienflora nachgewiesen
In parodontalen Taschen wurden Phagen sonst eher auf den atypischen, nicht der residenten oralen Flora zuzuordnenden Bakterien nachgewiesen. So sind bestimmte temperente Phagen mit lysogenem Zyklus auf das Bakterium Entercoccus faecalis spezialisiert. Der Keim ist zwar primär nicht oral-pathogen, kann aber bei fortgeschrittenen parodontalen und endodontalen Läsionen sehr wohl an der Progression der Erkrankung beteiligt sein. Auch weitere atypische Keime wie β-haemolysierende Streptokokken und Enterobakterien sind typische Bewohner tiefer progredienter Zahnfleischtaschen in Zusammenhang mit systemischen oder metabolischen Grunderkrankungen. Hier fördert die zusätzliche Präsenz wirtsspezifischer Phagen den destruktiven Krankheitsprozess.
Die Möglichkeiten eines therapeutischen Einsatzes von Phagen im Rahmen der Behandlung von systemischen und speziell oralen Infektionen werden im zweiten Teil dieses Beitrags diskutiert.
DDr. Christa Eder,
Fachärztin für Pathologie und Mikrobiologin, Wien
DDr. Christa Eder ist Fachärztin für Pathologie und Mikrobiologin. Seit vielen Jahren schreibt sie für das österreichische Fachmagazin „Zahn.Medizin.Technik“ und die dzw – Die ZahnarztWoche. Sie ist als Referentin im Bereich der zahnärztlichen Mikrobiologie international bekannt und Autorin zahlreicher Fachbücher zu zahnmedizinischen Themen.