Für eilige Leser
- Komplikationsraten sind bei Augmentation mit zirka 25 Prozent hoch.
- Das Risiko lässt sich mit sorgfältiger Patientenauswahl und gründlicher Diagnostik reduzieren.
- Wichtige Faktoren sind Defekttyp, regeneratives Potenzial und chirurgische Erfahrung.
- Neben autogenem Knochen können als Ersatz auch allogener und xenogener Knochen erfolgreich sein.
- Für horizontale und Defekte begrenzter Größe eignen sich Knochensplitting, GBR oder kleinere Knochenblöcke.
- Bei Sinusboden-Augmentationen erzielt ein Gemisch aus autogenem Knochen und resorptionsstabilem Ersatzmaterial die besten Ergebnisse.
- Bei vertikalen und ausgedehnten Defekten sind Knochenschalen, CAD/CAM-Titangitter oder größere Knochenblöcke aus verschiedenen Körperregionen einsetzbar.
- Wird simultan augmentiert und implantiert, sollte eine geschlossene Einheilung gewählt werden.
- Die Wundheilung kann mit Eigenblutkonzentraten unterstützt werden, für die jedoch wenige aussagekräftige Studien vorliegen.
Wer augmentiert, muss wie bei allen chirurgischen Eingriffen mit Problemen rechnen. So lag die Verlustrate bei Transplantation retromolarer Knochenblöcke in einer Fallserie bei 6,7 Prozent, temporäre Komplikationen wie Infektionen und Nervverletzungen summierten sich auf zusätzlich knapp 20 Prozent [1]. Bei größeren Eingriffen sind Komplikations- und Implantatverlustraten noch höher [2, 3]. Vermeiden oder im Schweregrad kontrollieren lassen sich diese bereits durch eine geeignete Patientenauswahl. So wird an der Universität Mainz der SAC-Risiko-Score um systemische Befunde wie HbA1c-Wert und Medikationen erweitert [4]. Patienten mit unkontrollierter Parodontitis, schlechter Mundhygiene und starke Raucher haben eine schlechtere Prognose – in Bezug auf den Implantat- und den Augmentationserfolg [5–7].
Im zweiten Schritt werden lokale Faktoren analysiert, wobei der Defekttyp die Therapie entscheidend bestimmt [8]. Im günstigen Fall kann auf Augmentationen verzichtet und stattdessen zum Beispiel ein kurzes Implantat gewählt werden [9]. Wichtig ist, ob das zukünftige Implantat von ein, zwei, drei oder vier Knochenwänden umgeben ist. Liegt das Augmentat innerhalb oder außerhalb des Weichgewebsmantels? Hat sich das Weichgewebe bereits an einen Knochendefekt angepasst? Ist es also kontrahiert und damit defizitär? Daraus lässt sich meist abschätzen, ob und in welcher Weise es sich für den Wundverschluss verwenden lässt [10].
Das regenerative Potenzial eines Defekts und damit die Erfolgsprognose hängt zudem davon ab, in welchem Mundbereich sich der Defekt befindet und wie gut die Gewebe entsprechend oder individuell durchblutet sind [11]. Da dies schwierig zu quantifizieren sein kann, spielt die Erfahrung des Chirurgs oder der Chirurgin eine große Rolle. Bisher nur experimentell lässt sich mit Doppler-Sonografie die Durchblutung von Weichgewebe untersuchen [12].
Eigen- oder Fremdmaterial?
Autogener Knochen gilt bis heute als Goldstandard für einen Großteil der Indikationen, ist aber mit Zweiteingriffen verbunden [5, 13]. Zudem können Ersatzmaterialien resorptionsstabiler sein als autogener Knochen, so dass zum Beispiel Gemische aus autogenen und xenogenen Knochenspänen Defekte zuverlässiger füllen. Unterschiede sind aber meist nicht signifikant [14]. Daraus folgt, dass verschiedene Materialien mit Erfolg verwendet werden können. Experten sind sich zugleich einig, dass bei Verwendung von Ersatzmaterialien einschließlich allogenem Knochen aus Gründen des Patientenschutzes klinisch gut dokumentierte Produkte bevorzugt werden sollten.
Leitlinie zu Knochenersatzmaterialien – jetzt ohne Interessenkonflikt?
Die im Juni 2020 publizierte Leitlinie „Implantologische Indikationen für die Anwendung von Knochenersatzmaterialien“ wurde im Rahmen des DGI-Online-Kongresses Ende November 2020 vorgestellt [10]. Koordinator Prof. Dr. Dr. Bilal Al-Nawas (Mainz) wies darauf hin, dass er als Koordinator und Dr. Dr. Markus Tröltzsch als federführender Autor nicht stimmberechtigt waren. Die klinischen Bewertungen fielen überwiegend fast einstimmig aus und erscheinen ausgewogen und nicht interessengeleitet. Bei vorangegangenen Versionen der Leitlinien war die Unabhängigkeit der Urheber häufig bezweifelt worden. Die Leitlinie ist im Volltext frei im Netz verfügbar.
Was aber ist die biologische Basis für diese Empfehlungen? Das Augmentat wirkt wegen mittelfristig meist fehlender vitaler Zellen überwiegend als Leitschiene für regenerative Vorgänge (Osteokonduktivität). Das gilt im Prinzip auch für autogenen Knochen. Dennoch wird dieser häufig bevorzugt eingesetzt, vor allem in kritischen Situationen wie bei bukkalen Dehiszenzen mit nur einer Knochenwand. Experten empfehlen auch, Implantatoberflächen mit partikuliertem Eigenknochen zu bedecken. Wissenschaftliche Evidenz zu dieser Frage ist aber nach Autorenkenntnis nicht vorhanden.
Splitten oder Raum schaffen?
Augmentationen sollten so wenig invasiv wie möglich sein. Daher kann es bei horizontalem Knochenbedarf sinnvoll sein, den Alveolarkamm mit Meißeln zu erweitern (Knochensplitting) und damit möglicherweise einen Zweiteingriff zu vermeiden. Wie der Privatdozent und niedergelassene Oralchirurg Dr. Dr. Andres Stricker auf der DGI-Tagung 2019 ausführte, muss der Alveolarkamm dafür mindestens 3–4 mm breit sein. Da mit einer basalen Fraktur zu rechnen sei, empfiehlt Stricker, apikal eine Kollagenmembran zu fixieren.
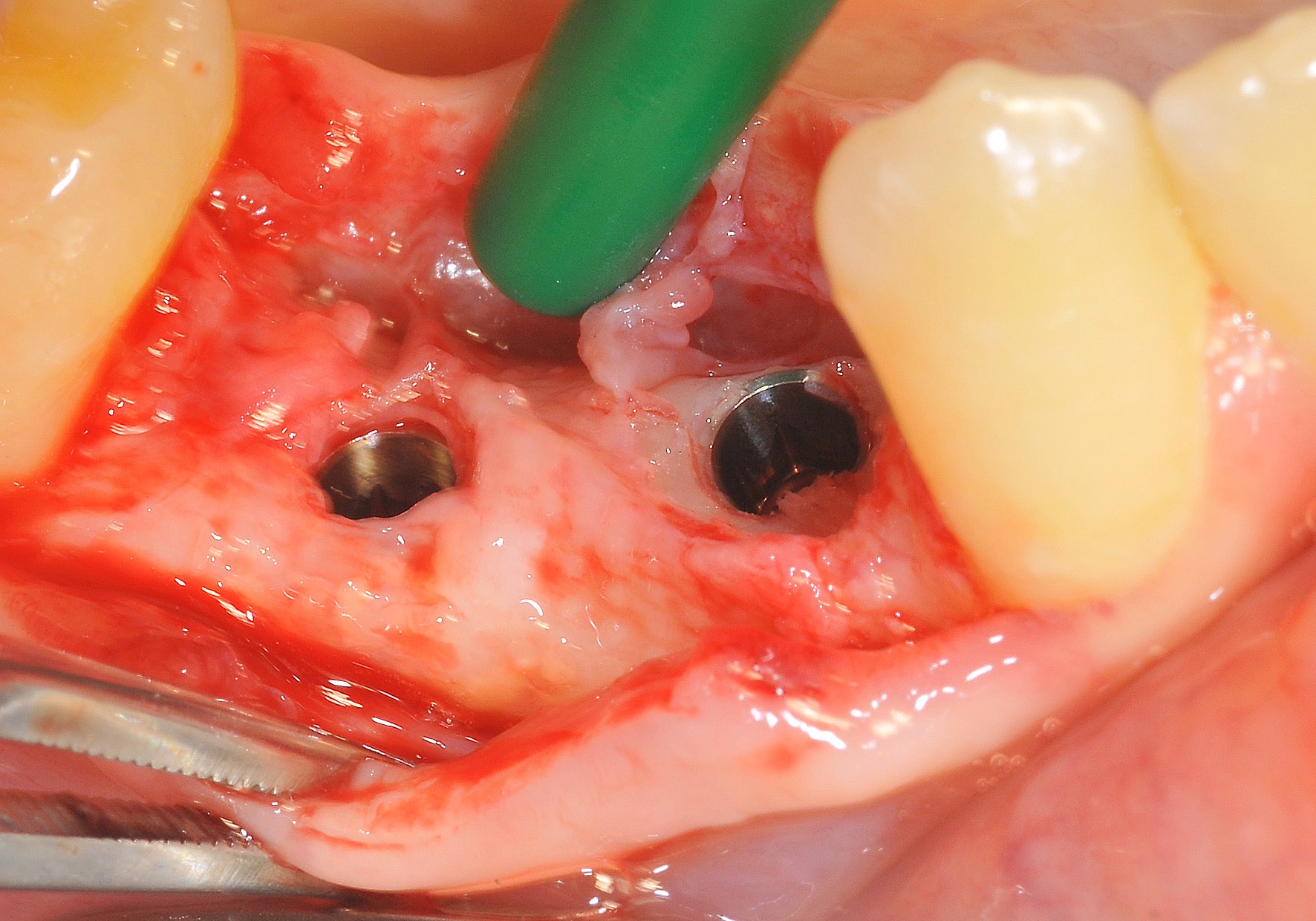
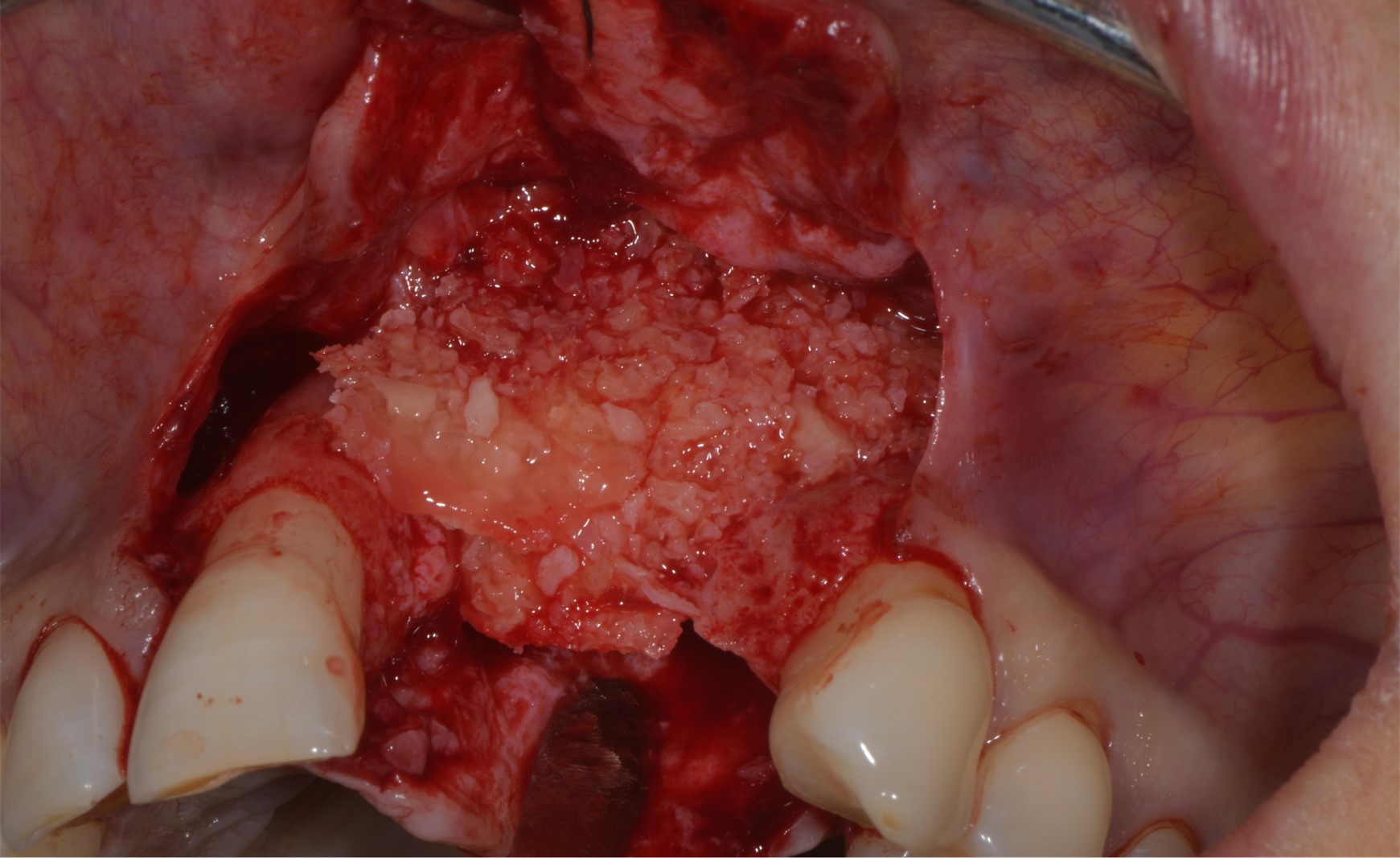
Dadurch werde auch ein stabiler regenerativer Raum geschaffen. Dieser geschützte Raum wurde bereits in den klassischen Studien von Dahlin und Mitarbeitern zum Thema gesteuerte Knochenregeneration (GBR) beschrieben [15, 16]. Für GBR-Maßnahmen verwendete Membranen haben zusätzlich biologische Effekte [17]. So dienen sie als Leitschiene während der Einheilung und können die molekularen Vorgänge von Zellen im Kontakt mit der Membran fördern, unter anderem durch zugesetzte bioaktive Substanzen (Abb. 1 bis 3).
Weitere Methoden, die auf dem Raumerhaltungsprinzip basieren, sind Knochenblock-Augmentationen (mit oder ohne zusätzliche GBR-Produkte) [18], autogene oder allogene Knochenschalen oder mit CAD/CAM hergestellte Titangitter [19-21]. Letztere müssen ebenso wie nicht resorbierbare Membranen in einem Zweiteingriff wieder entfernt werden. Eine klinische Überlegenheit einzelner Methoden lässt sich aus dem umfangreichen, aber sehr heterogenen Studienmaterial nicht ableiten [22].
Das gilt auch für Sinusboden-Augmentationen, bei denen mit 18 Prozent Membranperforation und 14,5 Prozent postoperativer Blutung ebenfalls erhebliche Komplikationsraten auftreten. Die Überlebensrate eingebrachter Implantate liegt nach 5 Jahren dennoch bei fast 98 Prozent [22]. In Bezug auf das verwendete Material erwies sich ein Gemisch aus autogenem Knochen und xenogenem Ersatzmaterial nach 5 bis 8 Monaten Einheilzeit als überlegen, auch gegenüber reinem Eigenknochen [23].
Extremer Defekt, extreme Augmentation
Verbleibende Knochenwände verbessern auch bei ausgeprägten Defekten die Prognose einer Augmentation [24]. Diese kann zum Beispiel notwendig sein, wenn eine große intermaxilläre Distanz überbrückt werden muss. Optionen sind aufgelagerte Knochenblöcke, die aus unterschiedlichen Regionen desselben Patienten oder von Spendern entnommen werden (allogen) . Hinzu kommen die Methoden Interpositions-Osteoplastik und Distraktions-Osteogenese, bei denen ein von intaktem Knochen begrenzter regenerativer Raum geschaffen wird [3].
Sind auch diese Methoden nicht mehr möglich, eignet sich bei extrem dünnen Knochenspangen im Unterkiefer die Tent-Pole-(Zeltstangen-)Technik (Abb. 4 und 5) [25]. Nur mit dieser lassen sich in manchen Fällen schwierig therapierbare Frakturen vermeiden.
Ein Schritt nach dem anderen
Die oben genannte Leitlinie bezieht sich dem Namen nach primär auf Knochenersatzmaterialien, enthält aber klinische Empfehlungen zu einer ganzen Reihe von Defektsituationen und klinischen Indikationen [10]. In Bezug auf das Timing wird festgehalten, dass „die komplexe vertikale Augmentation aufgrund der Weichgewebssituation anspruchsvoller ist als die horizontale“. Auch die Implantatprognose sinkt mit der Komplexität [26], so dass vor allem bei größeren Augmentationen zweizeitig implantiert werden sollte, also nach geschlossener Einheilung des Augmentats.
Wird bei überwiegend horizontalen Defekten gleichzeitig mithilfe von GBR augmentiert, verbessert eine Membran das Ergebnis [27]. Wird im ästhetischen Bereich ein Einzelimplantat zusammen mit dem Augmentat eingebracht, lassen sich nach einer Multizenterstudie mit transmukosaler Einheilung ebenso gute Ergebnisse erreichen wie mit geschlossener [28].
Wundheilung unterstützen
Ein großes Thema sind aktuell Eigenblutkonzentrate, die die Heilung nach Augmentationen fördern sollen. Randomisierte Vergleichsstudien liegen bisher überwiegend in Bezug auf Weichgewebe und Sinusaugmentationen vor und ein wissenschaftlicher Konsens ist noch nicht publiziert [29]. Eine aktuelle klinische Vergleichsstudie mit geringer Fallzahl deutet darauf hin, dass die zusätzliche Verwendung plättchenreichen Fibrins (PRF) gegenüber klassischer GBR bei lateraler Augmentation keine Vorteile bringen könnte [30].
Ein Zusatzeffekt blutbasierter Präparate könnte laut Expertenmeinungen bei offener Einheilung gegeben sein, zum Beispiel wenn ein weichgewebiger Verschluss nur schwierig zu erreichen oder das Heilpotenzial eingeschränkt ist [31]. Auch eine „Biologisierung“ von Membranen wird untersucht, was vor allem bei der auf der Basis von Fallberichten dokumentierten offenen Einheilung interessant sein könnte. Die Literatur spricht aber in Bezug auf erreichbare Augmentationsergebnisse noch klar für einen vollständigen weichgewebigen Verschluss [32].
Fazit und Ausblick
Augmentationen lassen sich im Zusammenhang mit Implantatversorgungen in vielen Fällen nicht vermeiden. Die hohen Komplikationsraten, auch wenn meist temporär, erfordern im Vorfeld eine sorgfältige Patientenselektion, in Verbindung mit eingehender lokaler Diagnostik und Fallplanung. Werden zusätzlich biologische Faktoren berücksichtigt, ist auch mittel- und langfristig die Erfolgswahrscheinlichkeit hoch.
Dr. Jan H. Koch, Freising
Hinweis: Dieser Beitrag kann nicht die klinische Einschätzung der Leser ersetzen. Er soll lediglich – auf der Basis aktueller Literatur und/oder von Experten-Empfehlungen – die eigenverantwortliche Entscheidungsfindung unterstützen.
Literatur
[1] Sakkas, A., et al.; GMS Interdiscip Plast Reconstr Surg DGPW 2016. 5 Doc21.
[2] Aloy-Prosper, A., et al.; Med Oral Patol Oral Cir Bucal 2015. 20 (2): e251-258.
[3] Urban, I. A., et al.; J Clin Periodontol 2019. 46 Suppl 21 319-339.
[4] Dawson, A., et al.; The SAC Classification in Implant Dentistry. Quintessence Publishing Co. 2009.
[5] Moy, P. K., et al.; Periodontol 2000 2019. 81 (1): 76-90.
[6] Strietzel, F. P., et al.; J Clin Periodontol 2007. 34 (6): 523-544.
[7] Heitz-Mayfield, L. J.; J Clin Periodontol 2008. 35 (8 Suppl): 292-304.
[8] Terheyden, H.; Dtsch Zahnärztl Z 2010. 65 320-331.
[9] Guljé, F. L., et al.; Clinical Oral Implants Research 2021. 32 (1): 15-22.
[10] DGI, DGZMK. AWMF-Registernummer: 083 009; Stand: Juli 2020
[11] Giannobile, W. V., et al.; Journal of Clinical Periodontology 2019. 46 (S21): 6-11.
[12] Tavelli, L., et al.; Journal of Clinical Periodontology n/a (n/a): .
[13] Sakkas, A., et al.; International Journal of Implant Dentistry 2017. 3 (1): 23.
[14] Troeltzsch, M., et al.; J Craniomaxillofac Surg 2016. .
[15] Dahlin, C., et al.; Plast Reconstr Surg 1988. 81 (5): 672-676.
[16] Dahlin, C., et al.; Int J Oral Maxillofac Implants 1989. 4 (1): 19-25.
[17] Omar, O., et al.; Journal of Clinical Periodontology 2019. 46 (S21): 103-123.
[18] Chappuis, V., et al.; Clin Implant Dent Relat Res 2017. 19 (1): 85-96.
[19] Keeve, P. L., et al.; Int J Oral Maxillofac Implants 2017. 32 (1): 137-146.
[20] Pérez-González, F., et al.; Med Oral Patol Oral Cir Bucal 2020. 25 (2): e291-e298.
[21] Chiapasco, M., et al.; Clinical Oral Implants Research n/a (n/a): .
[22] Jepsen, S., et al.; Journal of Clinical Periodontology 2019. 46 (S21): 277-286.
[23] Trimmel, B., et al.; Clinical Oral Implants Research 2021. 32 (2): 135-153.
[24] Khojasteh, A., et al.; Clinical Oral Implants Research 2017. 28 (10): e208-e217.
[25] Keweloh, M., et al.; Implantologie 2008. 16 (3): 317-330.
[26] Rammelsberg, P., et al.; Clinical Oral Implants Research 2012. 23 (10): 1232-1237.
[27] Thoma, D. S., et al.; Journal of Clinical Periodontology 2019. 46 (S21): 257-276.
[28] Cordaro, L., et al.; Clin Oral Implants Res 2012. .
[29] Ghanaati, S., et al.; J Oral Implantol 2018. 44 (6): 471-492.
[30] Hartlev, J., et al.; International Journal of Implant Dentistry 2021. 7 (1): 8.
[31] Solakoglu, O., et al.; Anatomischer Anzeiger = Ann Anat 2020; 231:151528.
[32] Garcia, J., et al.; Clinical Oral Implants Research 2018. 29 (3): 328-338.