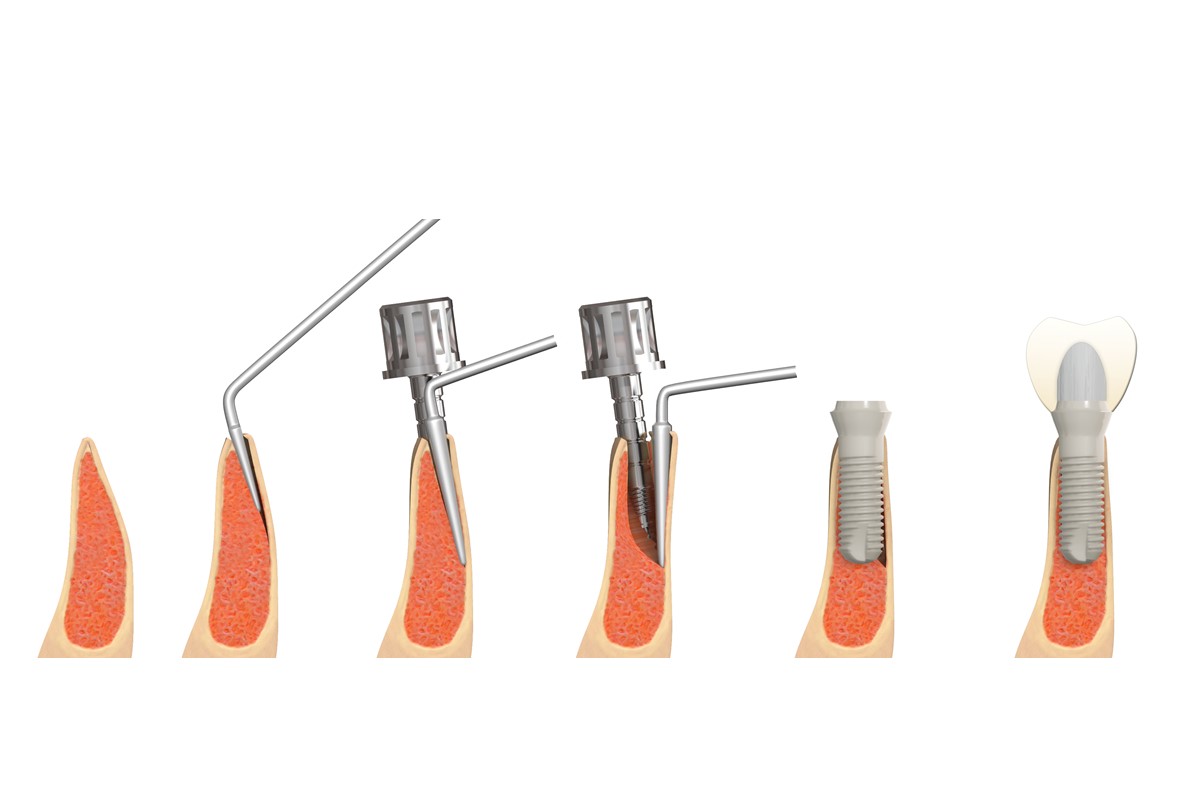
Seit der Einführung des Konzepts der „Guided Bone Regeneration“ (GBR) in die zahnärztliche Chirurgie Ende der 1980er-Jahre wurde diese Technik mehrfach modifiziert [1, 2]. Neben den verwendeten Knochenersatzmaterialien (KEM) wurden auch die eingebrachten Barriere-Membranen mit der Zeit verändert und weiterentwickelt. Im alltäglichen Gebrauch haben sich resorbierbare Kollagenmembranen tierischen Ursprungs in den Vordergrund gespielt.
Falldoku Heilungsverlauf nach Implantation/Augmentation und offener Einheilung mit PlasmaSafe
Allgegenwärtige Membranen
Neben der Frage, welche Membran Verwendung finden sollte, ließen sich Veröffentlichungen der vergangenen Jahre auch darüber aus, inwiefern die Platzierung, Befestigung – und zuletzt sogar Konditionierung, die sogenannte Biologisierung, die Ergebnisse beeinflussen. Durch diese Allgegenwärtigkeit des Themas Membranen in der Fachpresse und durch intensive Marktauftritte der verschiedenen Anbieter hat sich die Verwendung von Membranen im Praxisalltag durchgesetzt. Dies trotz eines relativ hohen Risikos für Komplikationen [3, 4].
Zu kurz kommt meiner Meinung nach die Frage, ob nicht grundsätzlich eher auf diese Fremdmaterialien verzichtet werden kann und sollte. Als Alternative bieten sich die aus autologen Blutplasmakonzentraten (BPC) gewonnenen Fibrin-Derivate an [5].
Die vier Prinzipien der geführten Knochenregeneration
Die geführte Knochenregeneration beruht in erster Linie auf vier Prinzipien: Ausschluss unerwünschter Gewebe und Zellen, Schaffung und Erhaltung von Räumen, Schutz des zugrunde liegenden Blutkoagels und Wundstabilisierung. Für eine erfolgreiche Knochenregeneration benötigen große Knochendefekte ein auffüllendes Ersatzmaterial und eine okklusive Membran [6].
- Membran:
Die wichtigste Aufgabe der Membran ist die Barrierefunktion. Es gilt das schnelle Einwandern von Weichgewebszellen (speziell: Epithelzellen) in unser Augmentat zu verhindern.
- Lagestabilität:
Es herrscht allgemeine Übereinstimmung, dass eine erfolgreiche Regeneration von Hartgewebe nur durch Ruhestellung des Augmentats zu erreichen ist. Wird das Material wiederholt mechanischer Belastung ausgesetzt und dadurch bewegt, wird die Osteogenese zugunsten einer fibrotischen Einheilung verhindert. Einige Protokolle der GBR beinhalten deshalb sogar das möglichst feste Spannen der Kollagenmembran über das Augmentat, um damit die stationäre Lage der Partikel sicherzustellen [8].
- Asepsis und Infektionsschutz:
Erste und wichtigste Anforderung an das Weichgewebsmanagement bei der GBR ist der speicheldichte und spannungsfreie Wundverschluss. Dies ist im Rahmen der Augmentation sicherlich die größte Herausforderung für viele Behandler, und damit erklärt sich auch bereits die am häufigsten beschriebene Komplikation der GBR: Die Angaben aus der Literatur beziffern zwischen 25 und 40 Prozent (bei vertikaler GBR) Wunddehiszenzen. Eine Dehiszenz erfor-dert in fast allen Fällen die vorzeitige Entfernung der Membran und führt in der Regel auch zum partiellen oder gar vollständigen Verlust des Augmentats. Erst seit der Imprägnierung von Kollagenmembranen mit BPC scheint eine längere Exposition des Kollagens ohne Infektion möglich [9]. Diese Verbesserung wird der bakteriostatischen Wirkung des Plasmakonzentrats zugeschrieben [10].
Blutplasmakonzentrate als Alternative?
Die aus autologen Blutplasmakonzentraten (BPC) gewonnenen Fibrin-Derivate finden immer weitere Verbreitung. Auch die Indikationen zur Verwendung konnten in jüngster Zeit ständig erweitert werden.
BPC sind in jeder Zubereitungsform bakteriostatisch, chemotaktisch und angiogenetisch. Zusammen mit der mechanisch stüt-
zenden und okklusiven Komponente des Fibrins erklärt sich damit bereits recht einfach ein Großteil der positiven Einflüsse auf das postoperative Heilungsgeschehen. Grundsätzlich unterscheidet man zwei Darreichungsformen der BPC: Plasmakonzentrat in flüssiger und in koagulierter Form.
Flüssige Plasmakonzentrate
Die Verwendung von BPCs in flüssiger Form (bekannt als PRP, PRGF, CGF und i-PRF) bieten dem Behandler neben der offensichtlichen Möglichkeit der Injektion auch die Option der gesteuerten Koagulation an. Bei dieser Technik wird die Polymerisation des Fibrins gezielt zur Inkorporation von partikulärem Material in das entstehende stabile Netz genutzt. Durch die Verbindung von BPC und autologem Knochen oder Knochenersatzmaterialien entsteht der sogenannte „Sticky Bone“ oder, durch eine spezielle Kombination, das „Kieler Sushi“. Diese Technik erzeugt ein formbares und lagestabiles Augmentat, das durch gute Ortsständigkeit im Defekt überzeugt.
Koaguliertes Plasma = Fibrin
Hierbei handelt es sich um ein Netzwerk aus Fibrin, das neben einer Menge Flüssigkeit auch Thrombozyten und Leukozyten bindet. Die Flüssigkeit kann ausgepresst werden, wodurch eine gummiartige Membran entsteht.
Bekannt ist diese Applikationsform vor allem als PRF. Dieses sehr stabile Fibringerüst, das sich durch eine lange Beständigkeit unter Mundbedingungen auszeichnet, ist leicht zu handhaben und sicher, zum Beispiel mit Nähten zu fixieren. Diese Anwendung ist einfach erlernbar und gut reproduzierbar.
Klinisches-Anwendungungsspektrum ständig erweitert
In den vergangenen Jahren hat sich das klinische Anwendungsspektrum von BPCs ständig erweitert. In den meisten Fällen findet man die Verwendung von „Sticky Bone“/„Kieler Sushi“ zur Defektauffüllung mit Abdeckung durch Fibrinmembranen. In dieser Kombination werden die oben genannten Anforderungen an eine erfolgreiche GBR mit anderen Mitteln erfüllt.
Deutliche Vereinfachung möglich
Durch die biologischen Eigenschaften der BPCs in Kombination mit einem sicheren Verfahren lassen sich sogar Operationstechniken modifizieren hin zu weniger invasiven, weniger komplizierten und weniger komplikationsanfälligen Techniken. Allein durch die Mischung von KEM mit BPC erfährt der augmentative Eingriff eine deutliche Vereinfachung des Handlings.Eine sichere und zielgerichtete Applikation des Materials führt zu kürzeren Eingriffszeiten, weniger verstreutem KEM und deutlich einfacherem Weichgewebsmanagement.
Dr. Oliver Scheiter, Illetas (Spanien)
Literatur
[1] C Dahlin, A Linde, J Gottlow, S Nyman; Healing of bone defects by guided tissue regeneration; Plast Reconstr Surg.1988 May;81(5):672-6
[2] Elgali I, Omar O, Dahlin C, Thomsen P.; Guided bone regeneration: materials and biological mechanisms revisited.
Eur J Oral Sci 2017; 125: 315–337
[3] Fontana et al.; Clinical classification of complications in guided bone regeneration procedures by means of a nonresorbable membrane; The International journal of periodontics & restorative dentistry 2011 June;31(3):265-73
[4] Glendale Lim, Guo-Hao Lin, Alberto Monje, Hsun-Liang Chan,Hom-Lay Wang; Wound Healing Complications Following Guided Bone Regeneration for Ridge Augmentation: A Systematic Review and Meta-Analysis; Int J Oral Maxillofac Implants 2018;33:41–50
[5] Gassling V, Douglas T, Warnke, PH, Acil Y, Wiltfang J, Becker ST. Platelet-rich fibrin membranes as scaffolds for periosteal tissue engineering.
Clin. Oral Impl. Res. 21, 2010; 543–549
[6] Kay SA, Wisner-Lynch L, Marxer M, Lynch SE. Guided bone regeneration: integration of a resorbable membrane and a bone graft material. Pract Periodontics Aesthet Dent. 1997 Mar;9(2):185-94; quiz 196. PMID: 12698525.
[7] Jepsen S, Schwarz F, Cordaro L, Derks J, Hämmerle CHF, Heitz-Mayfield LJ, Hernández-Alfaro F, Meijer HJA, Naenni N, Ortiz-Vigón A, Pjetursson B, Raghoebar GM, Renvert S, Rocchietta I, Roccuzzo M, Sanz-Sánchez I, Simion M, Tomasi C, Trombelli L, Urban I. Regeneration of alveolar ridge defects. Consensus report of group 4 of the 15th European Workshop on Periodontology on Bone Regeneration. J Clin Periodontol. 2019 Jun;46 Suppl 21:277-286. doi: 10.1111/jcpe.13121. PMID: 31038223.
[8] Urban IA, Monje A. Guided Bone Regeneration in Alveolar Bone Reconstruction. Oral Maxillofac Surg Clin North Am. 2019 May;31(2):331-338. doi: 10.1016/j.coms.2019.01.003. PMID: 30947850.
[9] Al-Maawi S, Herrera-Vizcaíno C, Orlowska A, Willershausen I, Sader R, Miron RJ, Choukroun J, Ghanaati S. Biologization of Collagen-Based Biomaterials Using Liquid-Platelet-Rich Fibrin: New Insights into Clinically Applicable Tissue Engineering. Materials (Basel). 2019 Dec 2;12(23):3993. doi: 10.3390/ma12233993. PMID: 31810182; PMCID: PMC6926831.
[10] Park JS, Pabst AM, Ackermann M, Moergel M, Jung J, Kasaj A. Biofunctionalization of porcine-derived collagen matrix using enamel matrix derivative and platelet-rich fibrin: influence on mature endothelial cell characteristics in vitro. Clin Oral Investig. 2018 Mar; 22(2): 909-917. doi: 10.1007/s00784-017-2170-7. Epub 2017 Jul 11. PMID: 28695450.