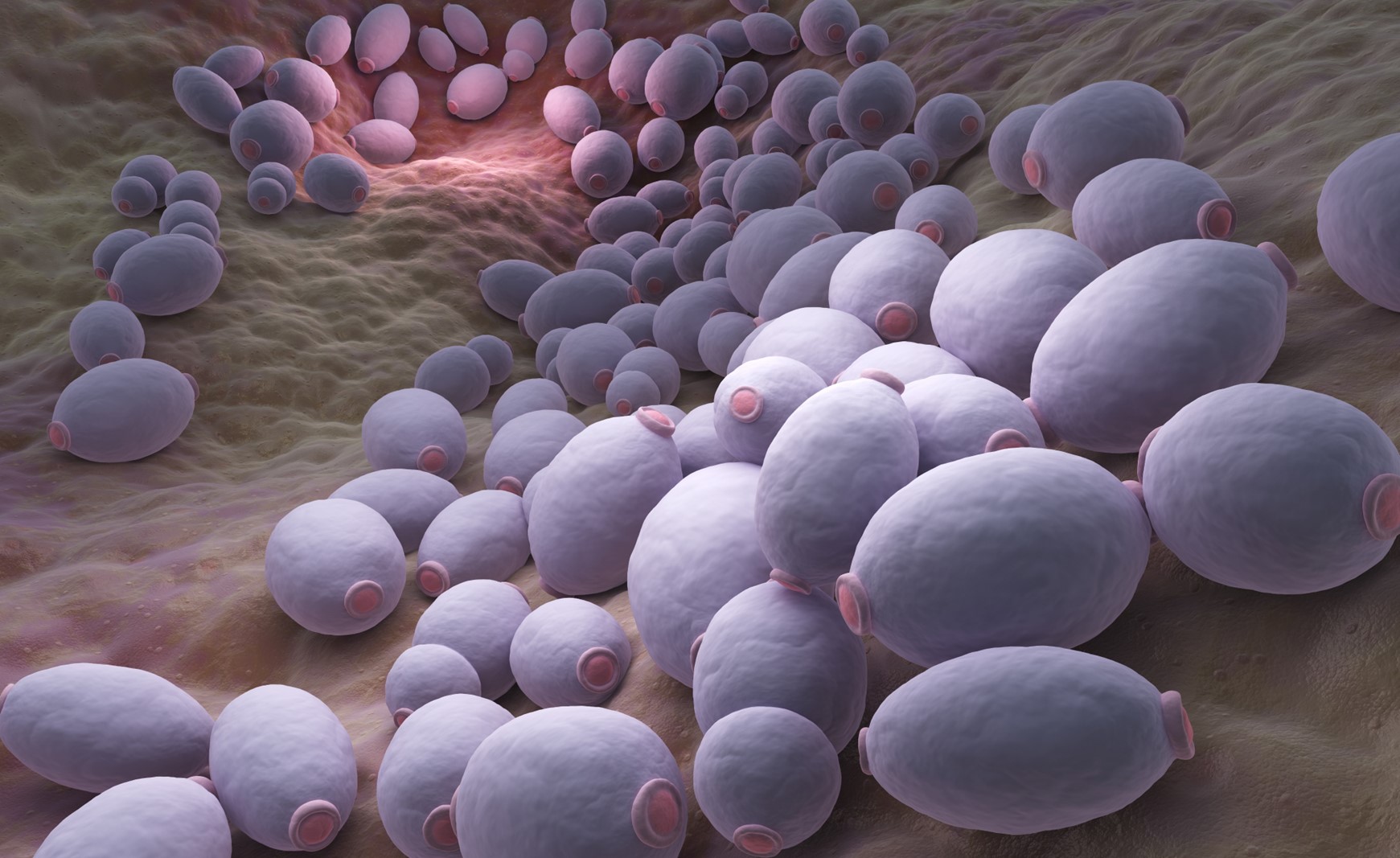
Fusobacterium nucleatum ist ein gramnegatives anaerobes Stäbchenbakterium, welches in hoher Zahl in der subgingivalen Plaque nachweisbar ist. Seine Rolle als Brückenbildner zwischen oralen grampostiven Primärbesiedlern und aggressiven Parodontalkeimen sowie seine Fähigkeit zur Invasion in das gingivale Bindegewebe und in Blutgefäße wurden bereits im ersten Teil dieses Artikels diskutiert.
Nun können Fusobakterien ihre Pathomechanismen und ihr gewebedestruktives Potenzial nicht nur an den oralen Strukturen, sondern auch systemisch einsetzen. Neben gynäkologischen Infektionen, Abszessen in inneren Organen und einer Beteiligung an der Genese und Progression von atheromatösen Plaques, verdient vor allem seine Assoziation zu kolorektalen Karzinomen besondere Beachtung.
F. nucleatum und das kolorektale Mikrobiom
Neue Forschungen beschäftigen sich mit den Zusammenhängen zwischen malignen Veränderungen der Darmmukosa und der Anwesenheit von Fusobacterium im Mikrobiom des Dickdarms. Genetische Vergleiche von F. nucleatum in den Zahnfleischtaschen mit jenen in der Darmflora zeigten, dass es sich bei den betroffenen Patienten um jeweils idente Stämme handelte. Die Keime kommen aus der Mundhöhle entweder direkt über den Gastrointestinaltrakt oder auf dem Weg der Bakteriämie in das Colon.
Dickdarmkarzinome haben wie viele andere Krebserkrankungen eine multifaktorielle Genese, wobei sowohl genetische Komponenten als auch diätische Konditionen und diverse Umweltfaktoren eine Rolle spielen. Die menschliche Darmschleimhaut wird von mehr als 1014 Mikroorganismen besiedelt. Das komplexe Mikrobiom des Darms interagiert über zahlreiche pathways mit den Zellen der Mukosa. Störungen und Verschiebungen der Anteile der beteiligten Spezies sowie Artenverarmung dieser mikrobiellen Biozönose gehen immer mit negativen Reaktionen der Wirtszellen einher. Chronische Entzündungen und die Entstehung von Tumoren sind mögliche Folgen.
Erhöhung des onkogenen Potenzials in entzündlichen Darmläsionen
Die Anwesenheit von F. nucleatum auf der Darmschleimhaut steigt massiv mit dem Ausmaß der Läsion. Auf intakter gesunder Mukosa ist der Keim entweder gar nicht oder nur in sehr geringen Mengen nachweisbar. Bei chronischer Entzündung steigt hingegen seine Präsenz bereits deutlich an. In gutartigen Adenomen ist F. nucleatum schon in höherer Zahl nachweisbar, im Karzinomgewebe kann man mittels PCR seine höchste Anreicherung feststellen.
Durch die Fähigkeit dieses Bakteriums zur Koaggregation mit anderen Keimen wie Campylobacter und Streptococcus kommt es zu einer synergistischen Promotion hinsichtlich Entstehung und Progression von Karzinomen. Wie auch an der Gingiva dringt der Keim über sein spezielles Oberflächenadhäsin FadA in die alterierten Gewebe des Darms ein. In kolorektalen Karzinomen findet man eine signifikante Erhöhung des FadA-Levels. Anstiege des bakteriellen Adhäsins im Gewebe eines noch gutartigen Adenoms korrelieren signifikant mit einer erhöhten Adenom/Karzinomsequenz. Die Anwesenheit von F. nucleatum induziert vor Ort eine massive Zytokinproduktion (IL-1, IL-8, IL-10, IL-18 und TNFα) und schafft damit ein proinflammatorisches Milieu.
Durch die Bindung des FadA an E-Cadherin, welches für wichtige Funktionen der Darmepithelzellen verantwortlich ist, blockiert er dieses Protein und aktiviert Signale, die zu einer erhöhten Expression von Onkogenen führen und so das Krebswachstum fördern. Es entsteht eine Art symbiontischer Beziehung zwischen Krebszelle und Bakterium. Bei der Metastasierung von Darmkarzinomen in die Leber oder in regionale Lymphknoten wird Fusobakterium als Teil des Metastasierungsgeschehens mitgenommen und ist dann auch in den Metastasen direkt nachweisbar.
Gefahr lokaler Immunsuppression und Resistenz gegen Chemotherapeutika
Zusätzlich interagiert ein weiteres Oberflächenprotein von F. nucleatum (Fap2) mit Rezeptoren von T-Lymphozyten. Dadurch wird der sonst protektive T-Zellrespons auf Mitogene und Antigene unterdrückt und ein für die Tumorentwicklung günstiges immunsuppressives Mikroklima geschaffen.
Im Tierversuch konnten bereits Zusammenhänge zwischen hohen Mengen von F. nucleatum mit genetischen Mutationen dargestellt werden. Durch die Unterstützung onkogener Signalketten findet man in F.-nucleatum-reichen Krebsgeweben eine Häufung prognostisch negativer genetischer Faktoren wie Mikrosatelliteninstabilität (MSI durch Ausfall von MLH1) oder Überexpression von KRAS und BRAF bei gleichzeitig hohen Levels von Antikörpern gegen F. nucleatum.
Ausgangspunkt sind parodontale Läsionen der Mundhöhle
Neue Untersuchungen zeigten, dass die Anwesenheit des Bakteriums im Karzinomgewebe Resistenzen des Tumors gegen Chemotherapie mit Oxaliplatin und 5-Fluoruracil begünstigt. Fusobakterium fördert die Expressionen eines bestimmten Ionenkanalproteins, welches die Krebszellen vor der Apoptose durch die Chemotherapeutika schützt.
Fusobacterium nucleatum ist mit Sicherheit nicht der einzige Faktor für das Wachstum kolorektaler Karzinome. Ob ihm als direktes Kanzerogen eine ähnliche Bedeutung zukommt wie etwa Helicobacter pylori bei der Entstehung von Magenkarzinomen und MALT- Lymphomen muss noch durch weitere Untersuchungen abgeklärt und bestätigt werden. In jedem Fall ist der Keim ein Risikofaktor und sein Ausgangspunkt sind parodontale Läsionen der Mundhöhle. Die zentrale Bedeutung der Mundgesundheit und die Wichtigkeit einer frühzeitigen und effektiven Therapie inflammatorischer Läsionen des Zahnhalteapparats wird aber durch die bereits bekannten Zusammenhänge einmal mehr bestätigt.