Autogene Blöcke galten lange Zeit als Standardaugmentationstechnik für vertikale Defekte. Heute zeigt die Literatur vergleichbare Ergebnisse für die GBR (Guided Bone Regeneration/Gesteuerte Knochenregeneration), die heute die am häufigsten angewandte Technik in dieser Indikation ist (Milinkovic 2014, Urban 2019). Bei der GBR werden Membranen verwendet, um einen Raum zwischen dem Knochendefekt und dem Periost zu schaffen und Bindegewebe und Epithelzellen auszuschließen, die schneller in den Defekt wandern. Dadurch erhalten die knochenbildenden Zellen den Raum und die Zeit, die sie benötigen, um den chirurgisch aufgebauten Bereich zu besiedeln und mit Knochen zu füllen (Dahlin 1988).
Die vertikale GBR ist keine neue Technik
Die erste menschliche Studie über die Verwendung von titanverstärkten PTFE-Membranen für vertikale Augmentationen wurde 1994 von Simion und seinem Team veröffentlicht (Simion 1994); diese Studie bezieht sich auf einen simultanen Ansatz, also die Knochenregeneration, die während desselben chirurgischen Schritts wie die Implantatinsertion durchgeführt wird. Dieser erfolgte nur mit dem Blutkoagel, also ohne Zugabe von Knochenersatzmaterialien oder autogenem Knochen. Dadurch wurde ein vertikaler Knochengewinn von 4 mm erzielt. Nach und nach wurde die Technik verfeinert mit dem Ergebnis, dass mit autogenem Knochen, der das osteogene Potenzial erhöht, ein vertikaler Gewinn von 7 bis 8 mm erreicht werden konnte, was mit Eigenblut allein nicht möglich war (Tinti 1996/1998, Simion 2001, Chiapasco 2004, Merli 2006/2007/2010/2014 ).
Dass ein Mischungsverhältnis zwischen autogenem Knochen und deproteinisiertem bovinem Knochenmineral (DBBM) von 50:50 Vorteile in Bezug auf die Stabilität des regenerierten Knochens – aufgrund der schwachen Resorption von DBBM – und die gute histologische Integration der DBBM-Partikel mit dem neu formierten Knochen hat, wurde 2007 erwiesen und kürzlich bestätigt. Mehrere Forscher fanden für dieses Vorgehen den gleichen Prozentsatz an neu gebildetem Knochen wie bei einer GBR, die zu 100 Prozent aus autogenem Knochen erfolgte (Simion 2007, Merli 2020). Die Technik entwickelt sich daher in Richtung einer Kombination aus DBBM und autogenem Knochen, die eine geringere Knochenentnahme und die Erhaltung des transplantierten Volumens im Laufe der Zeit ermöglicht (Simion 2016, Windisch 2021, Pistilli 2020, Urban 2014/2015a/2017/2019/2021). Weiterhin wurden allogene Transplantate allein oder in Kombination mit autogenen oder xenogenen Transplantaten untersucht (Fontana 2008, Cucchi 2017 und 2019).
Patientenauswahl
Patienten, die für diese Art von Eingriff in Frage kommen, müssen nach der ASA-Klassifikation Typ 1 oder 2 (bit.ly/2NXrYeg) entsprechen und dürfen keine Immunsuppressiva einnehmen. Vor dem Eingriff ist eine gründliche Vorbereitung erforderlich, um das Risiko einer bakteriellen Kontamination auszuschließen: parodontale Stabilisierung, Entfernung von Infektionsherden und Karies mit besonderer Aufmerksamkeit für die Zähne, die an die Lücke grenzen.
Es wird empfohlen, diese Art von Technik nur bei Nichtrauchern anzuwenden, da das Risiko einer Membranexposition bei Rauchern erhöht sein kann (Pistilli 2020). Die Patienten müssen Compliance und Motivation zeigen, da eine einwandfreie Hygiene unerlässlich ist und während der gesamten Behandlungsdauer eine regelmäßige Nachsorge erforderlich sein wird.
Technik
Diese Technik wurde ursprünglich von italienischen Teams Anfang der 2000er Jahre beschrieben und sie hat sich seither kaum weiterentwickelt. Allerdings haben sich das Design und das Material der Membranen gewandelt. Die Anwendung von Techniken zur gesteuerten Knochenregeneration und insbesondere die Verwendung von PTFE-Membranen erfordern das Erlernen eines strengen aseptischen Protokolls. Jedes Detail ist wichtig, um das Risiko einer bakteriellen Kontamination aus der Mundhöhle zu minimieren.
Wenn das Weichgewebe sehr dünn ist, ist eine vorbereitende Weichgewebstransplantation vor der vertikalen Augmentation kontraindiziert, da das Vorhandensein von Narbengewebe das Lappenmanagement und die Blutzufuhr für den Eingriff beeinträchtigt. Die Abbildung 1 zeigt den Ausgangsbefund im DVT. Im Bereich der krestalen keratinisierten Gingiva wird eine Inzision bis zum Knochen vorgenommen, danach eine mesiobukkale Entlastungsinzision bei mindestens zwei Zähnen Abstand von der Lücke und eine mesiolinguale Inzision bei dem Zahn, der die Lücke begrenzt. Zwei bukkale und linguale Mukoperiostlappen werden aufgeklappt (Abb. 2 und 3) und an der Empfängerstelle Perforationen vorgenommen (Abb. 4).
Die Membran wird zugeschnitten und in die gewünschte Form gebracht. Zwischen dem Rand der Membran und den benachbarten Zähnen wird ein Abstand von 1,5 bis 2 mm gelassen. Die Fixierung der Membran ist ein entscheidender Schritt, da die Immobilisierung des Transplantats für die Ossifikation unerlässlich ist. Die Fixierung wird zuerst lingual oder palatinal an mindestens zwei Punkten vorgenommen. Eine Mischung von 60 Anteilen autogenen Materials zu 40 Anteilen DBBM wird appliziert (Abb. 5). Dann wird die Membran nach vestibulär geklappt und mit Pins oder Schrauben fixiert (Abb. 6).
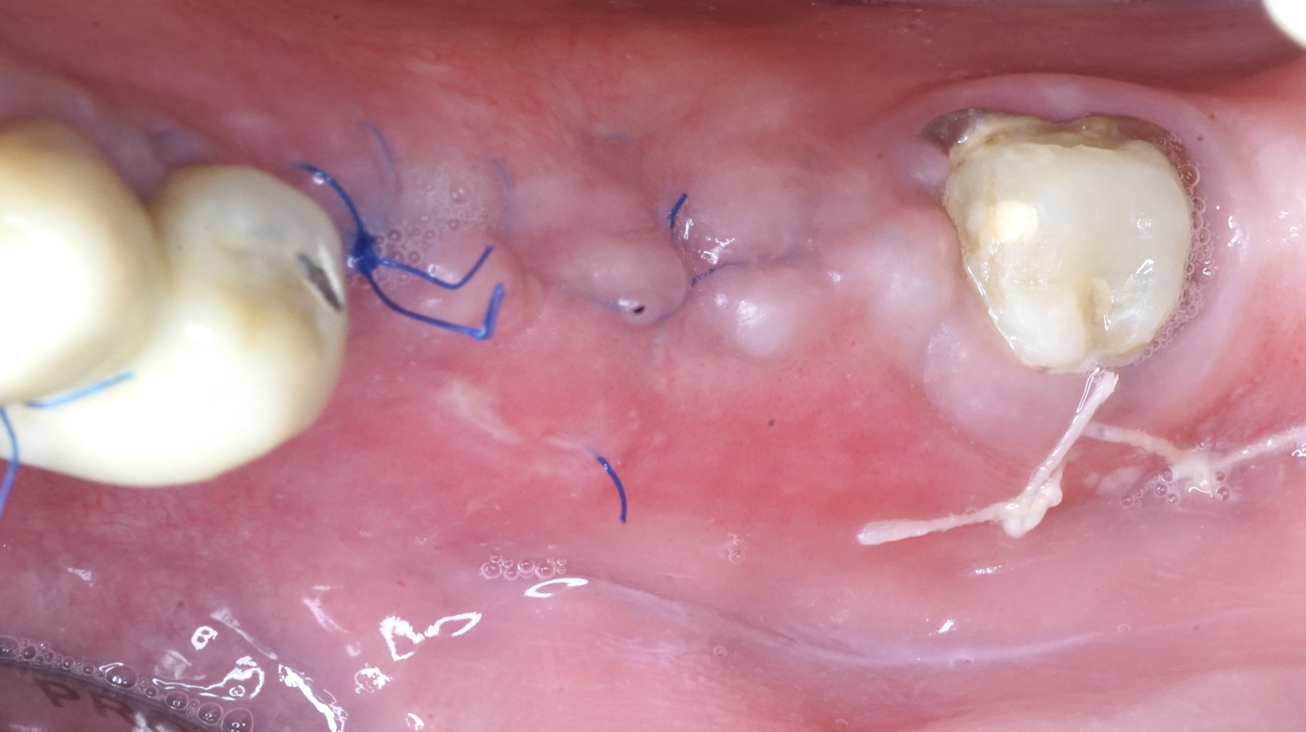
Die Nähte werden in zwei Ebenen angelegt: Als erste Verschlusslinie horizontale Matratzennähte, um eine mindestens 3 mm dicke Kontaktfläche zu schaffen, als zweite Verschlusslinie abwechselnd unterbrochene Einzelnähte (Tinti 1998 und 2001, Urban 2017) (Abb. 7). Die Patienten kommen in den ersten sechs Wochen alle 14 Tage und anschließend alle sechs Wochen zur Kontrolluntersuchung (Pistilli 2020). Die Situation bei der Wundkontrolle nach zwei Monaten, das Heilungsergebnis vor der Implantatfreilegung nach neun Monaten und den Knochengewinn im DVT zeigen die Abbildungen 8 bis 10.
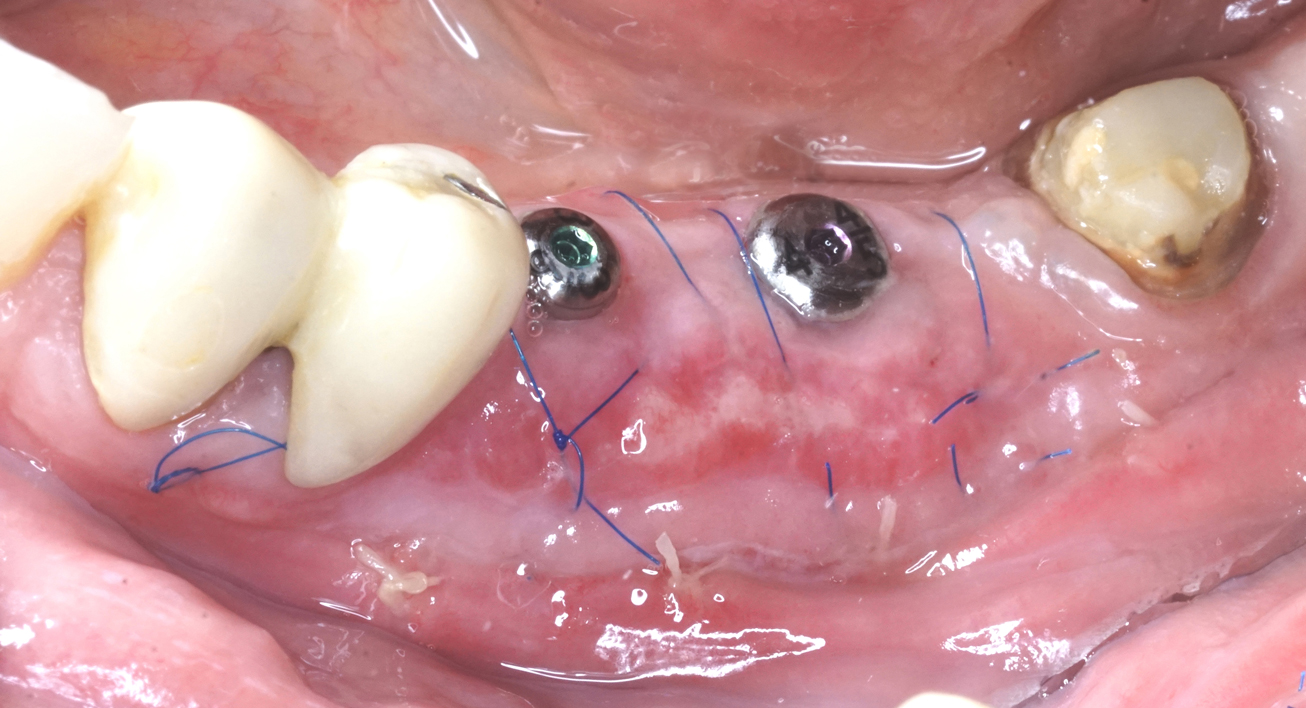
Beim zweizeitigen Vorgehen lässt man die Wunde neun Monate heilen, bevor die gedeckten Implantate eingesetzt werden. Die Implantate werden vier Monate später freigelegt (Simion 2004/2007, Urban 2017/2021b, Pistilli 2020) (Abb. 11 und 12). Bei der einzeitigen Methode lässt man die Implantate klassischerweise sieben Monate gedeckt einheilen, dann wird die nicht resorbierbare Membran entfernt, durch eine resorbierbare Membran ersetzt und die Implantate werden zwei Monate später freigelegt (Pistilli 2020). Abbildung 13 zeigt im hier vorgestellten Patientenbeispiel, wie bei der Freilegung das krestale Weichgewebe um die Implantate mit einer xenogenen Kollagenmatrix verdickt wird.
Vorteile der beschriebenen Technik
Wird Knochen verwendet, der mit einer Knochenmühle zerkleinert und mit dem Bone Scraper gewonnen wurde, lassen sich mit dieser Technik auch Patienten mit einem Minimum an verfügbarem Knochen oder mit mehreren zu augmentierenden Stellen behandeln. Sie ermöglicht auch die Behandlung von Situationen mit dünner Knochenschicht über dem Nerv, in denen sonst häufig keine Implantate verankert werden können. Schließlich ermöglicht es die Methode, eine Knochenhöhe von 8 bis 9 mm zu erhalten, die erforderlich ist, um eine 2 mm dicke Knochenschicht um das gesamte Implantat zu erzielen, die für die langfristige Stabilität des periimplantären Knochenniveaus erforderlich ist.
Welche Membran sollte verwendet werden?
Bei der Behandlung vertikaler Defekte ist die Verwendung von Titanmembranen sehr viel effizienter als von Kollagenmembranen. Grund ist, dass ihre Steifigkeit zur Immobilität des Transplantats und zur Aufrechterhaltung des Regenerationsraums beiträgt und so den umgebenden Muskelkräften widersteht. Kollagenmembranen haben die Tendenz, Druck auf die Augmentate auszuüben und damit das Augmentationsergebnis zu beeinträchtigen.
Die zunächst verwendeten e-PTFE-Membranen wurden später durch d-PTFE-Membranen ersetzt, die weniger durchlässig sind und theoretisch mit weniger infektiösen Komplikationen einhergehen. Es ist besser, mit einer bakteriendichten titanverstärkten PTFE-Membran zu beginnen. Diese auch im Fallbericht verwendete Membran (Cytoplast Titanium-Reinforced, Meisinger) ist so konzipiert, dass sie einige Wochen exponiert bleiben kann und toleranter gegenüber kleinen Fehlern ist. Bei einer Exposition, die nicht mit einer Infektion einhergeht, sollte man sechs Wochen warten und sie dann entfernen, was in der Regel mit einem minimalen Knochenverlust einhergeht (siehe Klassifikation von Komplikationen). Um insbesondere bei dünnen Biotypen das Risiko einer verzögerten Exposition zu verringern, wird versucht, möglichst dünne Membranen (150 bis 200 Mikrometer) zu verwenden.
Prof. Istvan Urban (Urban 2021b) hat kürzlich eine Membran entwickelt, die das Prinzip des klassischen Titangitters mit einer d-PTFE-Membran kombiniert (Reinforced PTFE Mesh, Cytoplast, Meisinger). Diese Membran besteht aus kreisförmigen Makroporen, die laut Hersteller eine direkte Verbindung zwischen dem geschaffenen chirurgischen Raum und dem darüber liegenden Periost ermöglichen. Urban entwickelte diese Membran, um die Geschwindigkeit der Revaskularisierung und Knochenreifung zu erhöhen, indem die Interaktion des Transplantats mit dem darüberliegenden Gewebe ermöglicht wird. Diese Eigenschaft ist bei kleinen Defekten nicht unbedingt erforderlich, wird aber mit zunehmender Größe des Defekts wertvoll.
Bei der von Urban beschriebenen Technik wird die neue Hybridmembran zusammen mit einer schnell resorbierbaren Kollagenmembran eingebracht, die sie bis zu ihrer Resorption bedeckt. Die Methode beruht auf der Tatsache, dass eine gesteuerte Knochenregeneration nur in den ersten drei bis vier Wochen einen Zellausschluss erfordert, was der Zeit entspricht, in der das Augmentat von osteoidem Gewebe besiedelt wird.
Wundheilung
Die Knochenbildung erfolgt von den nativen Wänden ausgehend zur Mitte und nach oben. Nach der Wundheilung ist im apikalen Drittel zum nativen Knochen hin histologisch reifer lamellärer Knochen zu beobachten, der mit den transplantierten Partikeln in Kontakt steht. In den mittleren und koronalen Dritteln hingegen werden häufiger unreifer Knochen, Osteoid und Knochenmark beobachtet (Simion 2007). Vertikale Defekte sind biologisch am anspruchsvollsten, da hier Knochenvolumen außerhalb der anatomischen Knochenkontur rekonstruiert werden muss. Die höchste Komplikationsrate ist bei der Regeneration der größten Defekte zu erwarten: Pistilli beobachtete eine dreifach höhere Komplikationsrate bei Defekten, die größer als 6 mm im posterioren Unterkiefer waren (Pistilli 2020). Neben der Größe bestimmt die Konfiguration des Defekts den biologischen Aufwand, der für seine Regeneration erforderlich ist. Je größer die vertikale und horizontale Ausdehnung eines offenen Defekts ist, desto schwieriger lässt sich dieser mit guter Knochenqualität regenerieren. Je schmaler und kleiner der Defekt ist, desto einfacher ist die Regeneration.
Wie die oben genannte Studie zeigt, konnte Urban mit der von ihm entwickelten Hybridmembran 100 Prozent der Höhe der Defekte regenerieren, die kleiner als 5 mm waren (Urban 2021b). Bei einer Defekthöhe zwischen 5 und 8 mm waren es 95,6 Prozent und bei einer Höhe von über 8 mm 89,4 Prozent. Über 5 mm Defekthöhe ist die Wahrscheinlichkeit, dass es gelingt, 100 Prozent des Defekts zu füllen, für jeden zusätzlichen Millimeter Defekt 2,5-mal geringer.
Reifung des regenerierten Knochens
Die Membran sollte so genau wie möglich an die Kontur des nativen Knochens angepasst werden. In Bereichen, in denen die Membran das Augmentat nicht vollständig bedeckt, sollte zusätzlich eine Kollagenmembran verwendet werden. Trotzdem ist zu erwarten, dass sich zwischen der Membran und dem darunter liegenden Augmentat ein Pseudoperiost entwickelt. In Kontakt mit diesem Pseudoperiost ist der darunterliegende neugebildete Knochen von schlechterer Qualität und weniger ausgereift (smear layer). Auch ohne Pseudoperiost kann diese oberflächliche Schicht des neugebildeten Knochens unzureichend gereift sein. Seine Reifung erfolgt nicht voraussagbar: Die oberflächliche Schicht wird weitestgehend resorbiert.
Um das zu verhindern, kann ein zweites Miniatur-Augmentat darübergelegt werden (Urban 2015a). Je nach Höhe des erreichten zervikalen Knochenniveaus kann man diesen Verlust auch akzeptieren und das Implantat etwas tiefer, etwa 1,5 mm unterhalb des Knochenniveaus, positionieren, um die Knochenresorption „vorauszudenken“. Diese Option vermeidet die Durchführung eines Sekundärtransplantats mit den damit verbundenen Nachbehandlungen und Risiken. Dieses Vorgehen wird häufig im Seitenzahnbereich bevorzugt, wenn das rekonstruierte zervikale Knochenniveau ausreichend ist.
Das Prinzip der Verwendung von perforierten PTFE-Hybridmembranen besteht darin, die Reifung des regenerierten Knochens durch die Interaktion des Augmentats mit pluripotenten Zellen des Periosts, die durch die Perforation der Membran ermöglicht wird, zu verbessern (Urban 2021). Diese Interaktion kann zu einer Neu-Vaskularisierung und möglicherweise auch zum Einwachsen von Osteoprogenitorzellen im oberflächlichen Teil des Transplantats führen. Die Ossifikation würde also aus zwei Quellen erfolgen: dem nativen Knochen und dem Periost. Es ist klinisch belegt, dass die Knochenneubildung in der Nähe dieser Membranen besser ist.
Histologie
Histologisch liegt der Prozentsatz an neu gebildetem Knochen, der nach sechs bis neun Monaten in vertikalen Augmentationen mit PTFE-Membranen erzielt wird, bei etwa 35 Prozent. Diese Zahl bezieht sich entweder auf ein Gemisch von xenogenem und autogenem Knochen (Simion 2007, Urban 2014) im Verhältnis 1:1, oder auf ein Augmentat aus entweder 100 Prozent allogenem oder 100 Prozent autogenem Knochen (Fontana 2008).
Weichgewebsmanagement
Der durch die Lappenentlastung erzielte Verschluss des Weichgewebes verdünnt das Gewebe und führt zu einer Verschiebung der Mukogingivalgrenze, wodurch das Vestibulum flacher wird (Abb. 14 und 15). Im Unterkiefer führt die Entlastung der lingualen und vestibulären Lappen zu einer weniger ausgeprägten Gewebeverzerrung als im Oberkiefer, wo die Steifheit und geringe Flexibilität des palatinalen Gewebes eine stärkere Mobilisierung des vestibulären Lappens erfordert. In der Folge ist es häufig notwendig, die Mukogingivalgrenze mit einem Verschiebelappen nach apikal zu verschieben und auf diese Weise die Umschlagfalte wieder zu vertiefen.
Wir halten uns an das Protokoll von Urban, der empfiehlt, weniger als 3 bis 4 mm dickes Weichgewebe im ersten Schritt zu augmentieren. Weil die biologische Breite auf Kosten des Knochengewebes wiederhergestellt wird, lässt sich auf diese Weise verhindern, dass ein Teil der regenerierten Knochenhöhe verloren geht (vgl. Abbildung 13). In einem zweiten Schritt empfiehlt er, falls erforderlich, einen apikalen Verschiebelappen mit freiem Gingivatransplantat vom Strip-Typ in Verbindung mit einer xenogenen Kollagenmatrix anzuwenden (Abb. 16-20). Wenn die keratinisierte Gingiva großflächig wiederhergestellt werden muss, hat Ersatzmaterial den Vorteil, dass kein oder nur wenig autogenes Gewebe entnommen werden muss (Urban 2015a und 2015b).
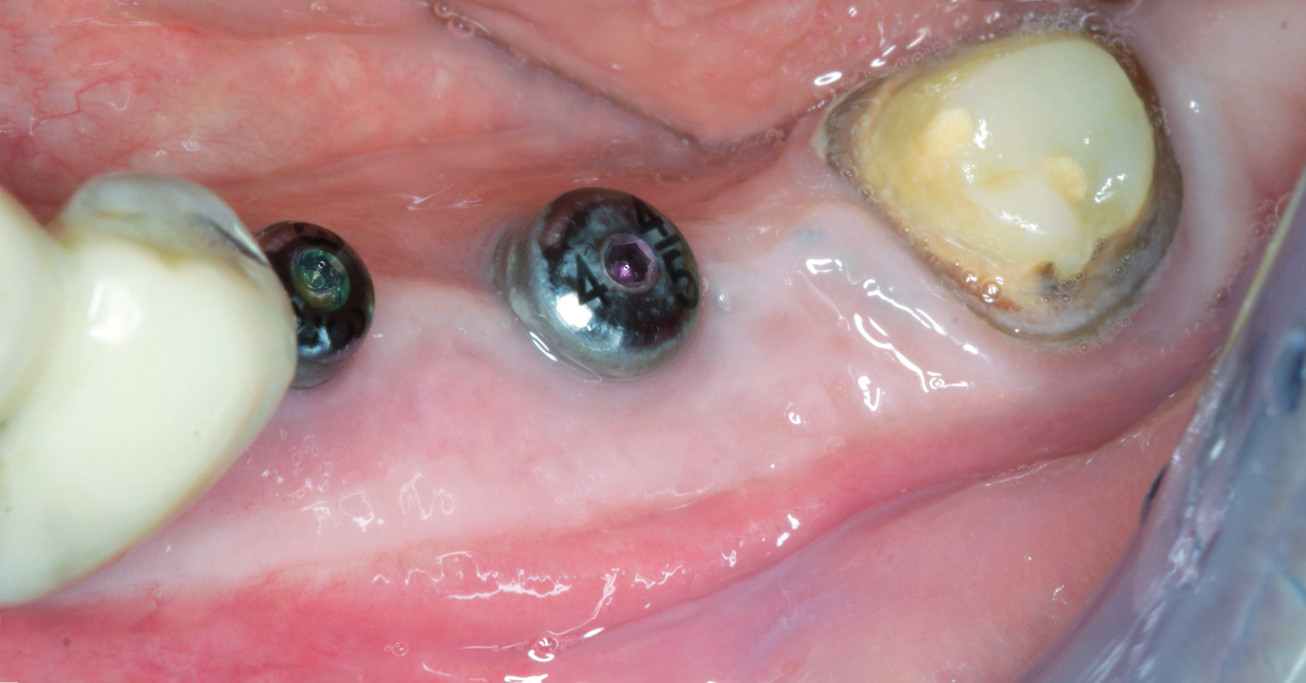
Keratinisierte Gingiva hilft, das periimplantäre Gewebe im Laufe der Zeit zu stabilisieren. Fontana berichtete eine Erfolgsrate von 82,1 Prozent für von keratinisierter Gingiva umgebene Implantate, verglichen mit 58,4 Prozent bei anderen Implantaten (Fontana 2015). Die Implantate können drei Monate nach dem abschließenden mukogingivalen Eingriff belastet werden, wobei die Patienten die Belastung in den ersten sechs Monaten nach prothetischer Versorgung nur allmählich steigern sollten (Pistilli 2020). Das klinische und radiologische Endergebnis zeigen die Abbildungen 21 bis 24.
Komplikationen
Die häufigsten Komplikationen im Rahmen von Augmentationen sind Infektionen und Expositionen. Die Komplikationsrate variiert je nach Studie zwischen sieben Prozent (Urban 2019) bis hin zu 45 Prozent (Rochietta 2008). Pistilli berichtet zum Beispiel von einer Expositionsrate von sieben Prozent (Pistilli 2020). Sicherlich spielt die Erfahrung des Operateurs mit der Technik bei der Inzidenz von Komplikationen eine wichtige Rolle. In seiner Metaanalyse berichtete Machtei (2001), dass Stellen mit Exposition sechsmal weniger vertikalen Knochengewinn aufwiesen als Stellen, die keine Exposition hatten. Daraus ergibt sich,wie wichtig es ist, dass Chirurgen schnell in Bezug auf jede Komplikation reagieren. Mit jedem Tag, der ohne angemessene Behandlung vergeht, steigt der Knochenverlust.
Es ist davon auszugehen, dass das Blutkoagel nach sechs Wochen ausreichend gereift ist, um mechanisch und biologisch ohne Membran bestehen und den Prozess der Ossifikation sicherstellen zu können. Tritt vorher eine Exposition auf, sollte die Heilungszeit möglichst um sechs Wochen verlängert werden. Das Team von Fontana und Simion (Fontana 2011) hat eine Klassifikation für das Verhalten bei Komplikationen entwickelt. Diese bezog sich auf e-PTFE-Membranen – d-PTFE-Membranen waren damals noch nicht auf dem Markt – und berücksichtigt eine In-vitro-Studie, die zeigte, dass die bakterielle Besiedlung dieser Art von Membranen innerhalb von drei bis vier Wochen erfolgte (Simion 1994).
- Klasse I: Expositionen von weniger als 3 mm ohne Infektion: örtliche Anwendung von Chlorhexidin, wöchentliche Pflege mit lokaler Zahnreinigung. Entfernung der Membran nach sechs Wochen, Einbringen einer Kollagenmembran und weichgewebiger Verschluss als erste Wahl (Urban 2009).
- Klasse II: Expositionen von mehr als 3 mm ohne Infektion: Früher wurde die sofortige Entfernung empfohlen. Heute ermöglichen geschlossene d-PTFE-Membranen, die für Bakterien weniger durchlässig sind, das gleiche Vorgehen wie bei Klasse I.
- Klasse III: Exposition in Verbindung mit einer akuten Infektion (Eiter und/oder Ödeme und/oder Schmerzen).
- Klasse IV: Akute Infektion ohne Exposition.
Die Klassen III und IV werden mit sofortigem Entfernen der Membran, Kürettage der Infektion, lokaler Anwendung von Doxycyclin (Urban 2012) und systemischer Antibiotikatherapie behandelt. Wir empfehlen außerdem, am Tag der Entfernung ein Antibiogramm anzufordern, um die Empfindlichkeit der Bakterien auf die gegebene Antibiose zu bestätigen.
Da partikuläre Transplantate schnell revaskularisieren können, ist es oft möglich, einen Teil des Transplantats zu erhalten. Aber es ist notwendig, sofort nach der Diagnose einer Infektion erneut zu intervenieren und die Situation nicht mit einem Antibiotikum zu „vertagen“, da dies die Ergebnisse des Antibiogramms verfälschen könnte. Dies bedeutet, dass die Patienten in den ersten sechs Wochen regelmäßig überwacht werden müssen. Tritt jedoch vor Ablauf von drei Wochen eine asymptomatische Infektion niedrigen Grades auf, die sich hauptsächlich durch Fistelung oder den Austritt von Biomaterialkörnern durch die Fistel oder die Inzision äußert, versucht man, wenn möglich, bis zur fünften oder sechsten Woche zu warten. Wird erst zu diesem Zeitpunkt erneut operativ eingegriffen, besteht die maximale Chance, das Augmentat ohne Membran zu erhalten.
Die Verwendung von d-PTFE-Membranen mit Makroporen ist anspruchsvoller, da es im Falle einer Exposition schnell zu einer bakteriellen Kolonisierung kommen kann. Außer bei sehr frühen Expositionen oder frühen niedriggradigen Infektionen, bei denen von Fall zu Fall entschieden werden muss, empfehlen wir die sofortige Entfernung dieser Membranen, unabhängig von der Größe der Exposition und dem Vorliegen einer Infektion.
Vertikaler Knochengewinn
Die derzeit veröffentlichten Literaturübersichten berichten für PTFE-Membranen über einen durchschnittlichen vertikalen Gewinn von etwa 4 mm, wobei der Gewinn bis zu 12 mm betragen kann (Milinkovic 2014, Elnayef 2018, Urban 2019). Die Erfolgsraten der in der Literatur berichteten erfolgreichen großen vertikalen Augmentationen wurden von talentierten und erfahrenen Chirurgen erzielt und können nicht verallgemeinert werden.
Marginaler Knochenumbau
Im Durchschnitt beträgt die Resorption während der Heilungsperiode 0,9 mm (Elnayef 2018). Simion beobachtete bei der gesteuerten Knochenregeneration, die mit einer e-PTFE-Membran und drei Fülltechniken (Eigenblut, 100 Prozent partikulierter autogener Knochen oder 1:1-Komposittransplantate DBBM/autogen) hergestellt wurden, einen Verlust von 2,11 mm ein Jahr nach Belastung der Implantate und von 3,16 mm 13 bis 20 Jahre nach Belastung: Er stellte fest, dass der Großteil des vertikalen Verlusts im ersten Jahr der Belastung des Implantats stattfand, unabhängig vom verwendeten Augmentationsmaterial (Simion 2016).
Urban beobachtete eine allmähliche Zunahme des marginalen Knochenverlusts im Laufe der Zeit: minus 1 mm nach fünf Jahren, minus 1,7 mm zwischen fünf und zehn Jahren und minus 2 mm zwischen zehn und 15 Jahren bei 1:1 Mischung von DBBM und autogenem partikulärem Knochen (Urban 2017). Urban verwendet ein sekundäres Knochentransplantat, um die erste vertikale Regeneration abzudecken, und erzielt damit unübertroffene Ergebnisse: Das marginale Knochenniveau wird regeneriert und dauerhaft über dem Implantathals gehalten: plus 1,39 mm nach sieben Jahren (Urban 2015a).
Der Text ist eine redaktionell überarbeitete Übersetzung aus dem Französischen. Originalpublikation: Dentoscope Nr. 243 vom Januar 2022

Abb. 24
Postoperative Panoramaschicht-Aufnahme.
Literatur
Chiapasco M, Romeo E, Casentini P, Rimondini L. Alveolar distraction osteogenesis vs. vertical guided bone regeneration for the correction of vertically deficient edentulous ridges: a 1-3-year prospective study on humans. Clin Oral Implants Res. 2004 Feb;15(1):82-95.
Cucchi A, Vignudelli E, Napolitano A, Marchetti C, Corinaldesi G. Evaluation of complication rates and vertical bone gain after guided bone regeneration with non-resorbable membranes versus titanium meshes and resorbable membranes. A randomized clinical trial. Clin Implant Dent Relat Res. 2017 Oct;19(5):821-832.
Cucchi A, Sartori M, Parrilli A, Aldini NN, Vignudelli E, Corinaldesi G. Histological and histomorphometric analysis of bone tissue after guided bone regeneration with non-resorbable membranes vs resorbable membranes and titanium mesh. Clin Implant Dent Relat Res. 2019 Aug;21(4):693-701.
Dahlin C, Linde A, Gottlow J, Nyman S. Healing of bone defects by guided tissue regeneration. Plast Reconstr Surg. 1988 May;81(5):672-6. doi: 10.1097/00006534-198805000-00004.
Elnayef, B., Porta, C., Suarez-Lopez Del Amo, F., Mordini, L., Gargallo- Albiol, J., & Hernandez-Alfaro, F. (2018). The fate of lateral ridge augmentation: A systematic review and meta-analysis. International Journal of Oral and Maxillofacial Implants, 33(3), 622–635.
Fontana F, Santoro F, Maiorana C, Iezzi G, Piattelli A, Simion M. Clinical and histological evaluation of allogeneic bone matrix versus autogenous bone chips associated with titanium-reinforced e-PTFE membrane for vertical ridge augmentation: A prospective pilot study. Int J Oral Maxillofac Implants 2008;23:1003–1012.
Fontana F, Maschera E, Rocchietta I, Simion M. Clinical classification of complications in guided bone regeneration procedures by means of a nonresorbable membrane. Int J Periodontics Restorative Dent. 2011 Jun;31(3):265-73.
Machtei EE. The effect of membrane exposure on the outcome of regenerative procedures in humans: a meta-analysis. J Periodontol. 2001 Apr;72(4):512-6.
Merli M, Bernardelli F, Esposito M. Horizontal and vertical ridge augmentation: a novel approach using osteosynthesis microplates, bone grafts, and resorbable barriers. Int J Periodontics Restorative Dent. 2006 Dec;26(6):581-7.
Merli M, Migani M, Esposito M. Vertical ridge augmentation with autogenous bone grafts: Resorbable barriers sup- ported by ostheosynthesis plates versus titanium-reinforced barriers. A prelimi- nary report of a blinded, randomized controlled clinical trial. Int J Oral Maxil- lofac Implants 2007;22:373–382.
Merli M, Lombardini F, Esposito M. Vertical ridge augmentation with autogenous bone grafts 3 years after loading: resorbable barriers versus titanium-reinforced barriers. A randomized controlled clinical trial. Int J Oral Maxillofac Implants. 2010 Jul-Aug;25(4):801-7.
Merli M, Moscatelli M, Mariotti G, Rotundo R, Bernardelli F, Nieri M. Bone level variation after vertical ridge augmentation: resorbable barriers versus titanium-reinforced barriers. A 6-year double-blind randomized clinical trial. Int J Oral Maxillofac Implants. 2014 Jul-Aug;29(4):905-13
Merli M, Nieri M, Mariotti G, Merli M, Franchi L, Quiroga Souki B. The fence technique: Autogenous bone graft versus 50% deproteinized bovine bone matrix / 50% autogenous bone graft-A clinical double-blind randomized controlled trial. Clin Oral Implants Res. 2020 Dec;31(12):1223-1231.
Milinkovic, I., & Cordaro, L. (2014). Are there specific indications for the different alveolar bone augmentation procedures for implant placement? A systematic review. International Journal of Oral and Maxillofacial Surgery, 43(5), 606–625.
Pistilli R, Simion M, Barausse C, Gasparro R, Pistilli V, Bellini P, Felice P. Guided Bone Regeneration with Nonresorbable Membranes in the Rehabilitation of Partially Edentulous Atrophic Arches: A Retrospective Study on 122 Implants with a 3- to 7-Year Follow-up. Int J Periodontics Restorative Dent. 2020 Sep/Oct;40(5):685-692.
Polimeni, G., Xiropaidis, A. V., & Wikesjo, U. M. (2006). Biology and princi- ples of periodontal wound healing/regeneration. Periodontology 2000, 41(1), 30–47
Rocchietta I, Fontana F, Simion M. Clini- cal outcomes of vertical bone augmenta- tion to enable dental implant placement: A systematic review. J Clin Periodontol 2008;35(suppl):203–215.
Simion M, Trisi P, Piattelli A. Vertical ridge augmentation using a membrane tech- nique associated with osseointegrated implants. Int J Periodontics Restorative Dent 1994;14:496–511.
Simion M, Trisi P, Maglione M, Piattelli A. A preliminary report on a method for studying the permeability of expanded polytetrafluoroethylene membrane to bacteria in vitro: A scanning electron mi- croscopic and histological study. J Peri- odontol 1994;65:755–761.
Simion M, Jovanovic SA, Trisi P, Scarano A, Piattelli A. Vertical ridge augmentation around dental implants using a mem- brane technique and autogenous bone or allografts in humans. Int J Periodontics Restorative Dent 1998;18:8–23.
Simion M, Jovanovic SA, Tinti C, Benf- enati SP. Long-term evaluation of osseo- integrated implants inserted at the time or after vertical ridge augmentation. A retrospective study on 123 implants with 1-5 year follow-up. Clin Oral Implants Res 2001;12:35–45.
Simion M, Fontana F, Raperini G, Maiorana C. Vertical ridge augmentation by expanded-polytetrafluoroethylene membrane and a combination of intraoral autogenous graft and deproteinized anorganic bovine bone (Bio Oss). Clin. Oral Impl. Res. 18, 2007; 620–629
Simion M, Ferrantino L, Idotta E, Zarone F. Turned Implants in Vertical Augmented Bone: A Retrospective Study with 13 to 21 Years Follow-Up. Int J Periodontics Restorative Dent. 2016 May-Jun;36(3):309-17.
Tinti C, Parma-Benfenati S, Polizzi G. Vertical ridge augmentation: What is the limit? Int J Periodontics Restorative Dent 1996;16:221–229.
Tinti C, Parma-Benfenati S. Vertical ridge augmentation: surgical protocol and retrospective evaluation of 48 consecutively inserted implants. Int J Periodontics Restorative Dent. 1998 Oct;18(5):434-43.
Urban IA, Jovanovic SA, Lozada JL. Vertical ridge augmentation using guided bone regeneration (GBR) in three clinical scenarios prior to implant placement: a retrospective study of 35 patients 12 to 72 months after loading. Int J Oral Maxillofac Implants. 2009 May-Jun;24(3):502-10.
Urban IA, Nagursky H, Church C, Lozada JL. Incidence, diagnosis, and treatment of sinus graft infection after sinus floor elevation: a clinical study. Int J Oral Maxillofac Implants. 2012 Mar-Apr;27(2):449-57.
Urban IA, Lozada JL, Jovanovic SA, Nagursky H, Nagy K. Vertical ridge augmentation with titanium-reinforced, dense-PTFE membranes and a combination of particulated autogenous bone and anorganic bovine bone-derived mineral: a prospective case series in 19 patients. Int J Oral Maxillofac Implants. 2014 Jan-Feb;29(1):185-93.
Urban IA, Monje A, Wang HL. Vertical Ridge Augmentation and Soft Tissue Reconstruction of the Anterior Atrophic Maxillae: A Case Series. Int J Periodontics Restorative Dent. 2015(a) Sep-Oct;35(5):613-23.
Urban IA, Lozada JL, Nagy K, Sanz M. Treatment of severe mucogingival defects with a combination of strip gingival grafts and a xenogeneic collagen matrix: a prospective case series study. Int J Periodontics Restorative Dent. 2015(b) May-Jun;35(3):345-53.
Urban IA, Monje A, Lozada JL, Wang HL. Long-term Evaluation of Peri-implant Bone Level after Reconstruction of Severely Atrophic Edentulous Maxilla via Vertical and Horizontal Guided Bone Regeneration in Combination with Sinus Augmentation: A Case Series with 1 to 15 Years of Loading. Clin Implant Dent Relat Res. 2017 Feb;19(1):46-55.
Urban I, Traxler H, Romero-Bustillos M, Farkasdi S, Bartee B, Baksa G, Avila-Ortiz G. Effectiveness of Two Different Lingual Flap Advancing Techniques for Vertical Bone Augmentation in the Posterior Mandible: A Comparative, Split-Mouth Cadaver Study. Int J Periodontics Restorative Dent. 2018 Jan/Feb;38(1):35-40.
Urban, I. A., Montero, E., Monje, A., & Sanz-Sanchez, I. (2019). Effectiveness of vertical ridge augmentation interventions: A systematic review and meta-analysis. Journal of Clinical Periodontology, 46(Suppl 21), 319–339.
Urban IA, Ravidà A, Saleh MHA, Galli M, Lozada J, Farkasdi S, Wang HL. Long-term crestal bone changes in implants placed in augmented sinuses with minimal or moderate remaining alveolar bone: A 10-year retrospective case-series study. Clin Oral Implants Res. 2021 Jan;32(1):60-74.
Urban IA, Saleh MHA, Ravidà A, Forster A, Wang HL, Barath Z. Vertical bone augmentation utilizing a titanium-reinforced PTFE mesh: A multi-variate analysis of influencing factors. Clin Oral Implants Res. 2021(b);32(7):828-839.
Windisch P, Orban K, Salvi GE, Sculean A, Molnar B. Vertical-guided bone regeneration with a titanium-reinforced d-PTFE membrane utilizing a novel split-thickness flap design: a prospective case series. Clin Oral Investig. 2021 May ;25(5):2969-2980.
Titelbild: Osteogenetics Biomedical Inc.