Einfluss des orales Mikrobioms
Resistenzen gegen antibiotische Wirkstoffe sind ein zunehmendes Problem in der modernen Medizin. Sie verursachen schwere Komplikationen bei der Behandlung von Infektionen und sind für etwa 1,2 Millionen Todesfälle pro Jahr weltweit verantwortlich.
Die Mikroorganismen der großen Mikrobiome unseres Körpers, zu welchen auch das orale Mikrobiom zählt, spielen für den Austausch von Genen und damit auch als Reservoir für mögliche Resistenzen eine zentrale Rolle. Die Integrität der Gewebe unserer Mundhöhle ist ein wichtiger Parameter für den gesamten Organismus und für unsere Lebensqualität.
Einfluss auf systemische Faktoren lange unterschätzt
Der Einfluss des oralen Mikrobioms auf systemische Faktoren wurde viele Jahre unterschätzt und begrenzt auf die lokalen Strukturen wie Zähne, Parodontium und Mundschleimhaut betrachtet.
Erkrankungen wie Karies, Gingivitis, Parodontitis und Stomatitis wurden bestimmte Leitkeime als Auslöser und Betreiber zugeordnet, die Interaktionen zwischen den verschiedenen Spezies der oralen Biozönosen und mit dem wirtseigenen Zellstoffwechsel aber lange unterschätzt.
Nicht nur die Zahngesundheit ist in Gefahr: Eine orale Dysbiose kann durch die offenen Verbindungen zwischen Mundhöhle, Gastrointestinaltrakt und Atemwegen und nicht zuletzt bakteriämisch über das Blutgefäßsystem sowohl die inneren Organe, wie das Herz/Kreislaufsystem, die Lungen, den Darm, die Leber, die Nieren, als auch das Nervensystem beeinträchtigen und schädigen.
Unkontrollierter Antibiotikaeinsatz fördert Resistenzbildung
Nach Angaben der FDI werden fast 75 Prozent aller Antibiotika im niedergelassenen Bereich, 10 Prozent davon von Zahnärzten, verschrieben. Veränderungen des oralen Mikrobioms werden allerdings durch jede, gegen welche Erkrankung auch immer gerichtete systemische Antibiose ausgelöst. Das Medikament ist in seiner Wirkung nicht auf den eigentlichen Zielort beschränkt, sondern betrifft immer den gesamten Organismus und damit auch die mikrobielle Lebewelt der Mundhöhle. Ursachen für die Begünstigung einer Resistenzbildung sind hinlänglich bekannt.
Risiko Breitbandantibiotika
An erster Stelle steht die unreflektierte Gabe von Breitbandantibiotika. Die verursachenden Erreger werden, sowohl im allgemeinmedizinischen als auch im zahnärztlichen Bereich, nur selten auf ihre Sensibilität auf die verordneten Wirkstoffe getestet, die meisten Gaben erfolgen rein empirisch. Auch „Vorsichtshalber-Gaben“ bei eigentlich viralen Infektionen wie grippalen Infekten wirken sich zwar nicht begünstigend auf Behandlung dieser Erkrankung aus, verändern aber die Komposition und das Sensibilitätsspektrum der Spezies der oralen Biozönose. Zudem werden Mindestdosierung und die Dauer der Medikation von den Patienten häufig nicht eingehalten oder die vom letzten Mal übrig gebliebenen Antibiotika in Eigenregie selbstverordnet.
Antibiotika in der Zahnarztpraxis
Auch in der Zahnarztpraxis ist eine adjuvante Antibiotikagabe bei bestimmten Indikationen wie aggressiver Parodontitis, Abszessen oder Wurzelgranulomen eine gängige Praxis. Die antibiotische Begleittherapie wird allerdings erheblich erschwert, wenn die an sich schon mit potenten Virulenzfaktoren ausgestatteten Keime eines destabilisierten Mikrobioms auch noch Resistenzen gegen antibiotische Wirkstoffe entwickeln.
Biofilme als Reservoir für Resistenzgene
- Ein gängiger Fehler, der neben den bereits genannten Faktoren eine Resistenzentstehung fördert, ist eine Antibiotikagabe bei aggressiver Parodontitis ohne zeitlichen Konnex zu einer mechanischen Reinigung der Zahnfleischtaschen.
- Die subgingivalen Mikroorganismen sind in Biofilmen organisiert. Das Antibiotikum kann nur in verringerter Konzentration zu den durch eine organische Matrix geschützten Keimen vordringen.
- Die Wirksamkeit ist entsprechend abgeschwächt, der Großteil der Erreger übersteht die Antibiose weitgehend unbeschadet.
- Die Resistenzentwicklung hingegen wird durch die Exposition zu unzureichenden Antibiotikadosen vorangetrieben.
Antibiotikaresistenzen verursachen schwere Komplikationen bei der Behandlung von Infektionen und sind für etwa 1,2 Millionen Todesfälle pro Jahr weltweit verantwortlich.
Mobile genetische Elemente
Innerhalb eines Biofilms findet man gegenüber planktonisch lebenden Bakterien, wie etwa im Speichel, neben vermehrter Virulenz auch einen erhöhten Level an Antibiotikaresistenzen. Viele Resistenzgene (ARGs) liegen extrachromosomal auf mobilen genetischen Elementen, den sogenannten Plasmiden.
Diese können in der polymikrobiellen Biozönose über horizontalen Gentransfer innerartlich aber auch zwischen den unterschiedlichen Bakterienspezies ausgetauscht und weitergegeben werden. Dies betrifft allerdings nicht nur potenziell pathogene Mikroorganismen wie Prevotella intermedia, Porphyromonas gingivalis oder Aggregatibacter actinomycetemcomitans, sondern auch die an sich harmlosen Kommensalen der Mundflora.
Letztere beeinträchtigen zwar nicht die Mundgesundheit, können aber bei einem Erwerb von Resistenzgenen zu einer Gefahr für den Gesamtorganismus werden.
Mittels metagenomischer Sequenzierung von Plaqueproben wurden Resistenzprofile zur Darstellung des oralen Resistoms erstellt. Es finden sich deutliche Unterschiede in den Resistenzmustern zwischen oral Gesunden und Patienten mit Karies oder Parodontitis.
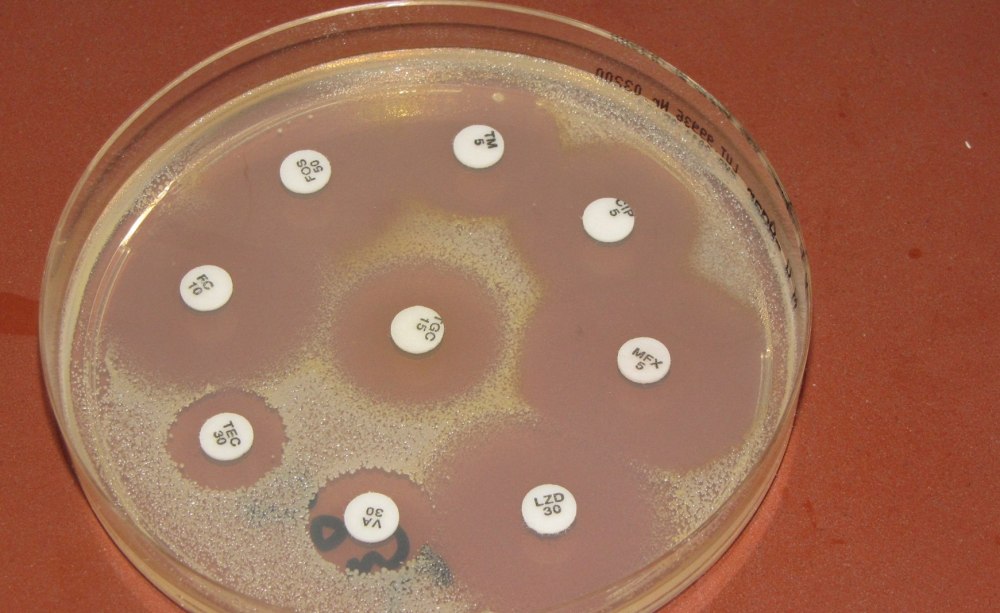
Plättchendiffusionstest: Analysen des verursachenden Keimkollektivs und Sensibilitätstests ermöglichen den gezielten Einsatz von Wirkstoffen.
Ko- und Kreuzresistenzen erschweren die Behandlung
Neben Antibiotikaresistenzen kommen auch damit oft kombiniert auftretenden Resistenzen gegen andere Biozide zum Tragen. Die Ursache liegt in einer gemeinsamen Selektion der verantwortlichen Gene, wodurch sich Ko- und Kreuzresistenzen entwickeln.
Betroffen sind grampositive Bakterien wie Staphylococcus aureus mit seiner methicillinresistenten Form MRSA, aber zunehmend auch gramnegative Keime. In tiefen Zahnfleischtaschen findet man häufig Klebsiellaarten, Enterobacterales und Escherichia coli. Unter entsprechendem Selektionsdruck entstehen Resistenzen gegen Beta-Laktam-Antibiotika (ESBL), aber auch gegen Fluorchinolone und Sulfamethoxazol. Multiresistente gramnegative Keime (MRGN) sind unempfindlich gegen drei (3MRGN) oder sogar vier (4 MRGN) Antibiotikaklassen.
Auch unter den Anaerobiern und den fakultativ anaeroben Bakterien findet man zunehmend Lücken im Wirkungsspektrum von Clindamycin, Doxycyclin und den Makroliden.
- Um dieser Entwicklung effektiv entgegenzuwirken, sind sowohl ein problemorientiertes und erregerspezifisches Vorgehen bei der Verschreibung von Antiinfektiva als auch eine Optimierung bei der Unterweisung der Patienten notwendig.
- Im zahnärztlichen Bereich ermöglichen Analysen des verursachenden Keimkollektivs und Sensibilitätstests einen gezielten Einsatz von Wirkstoffen.
- Schulungen im Rahmen des Antibiotic Stewardship sollten im niedergelassenen und vor allem auch im zahnärztlichen Bereich vermehrt angeboten werden.
Eine auf den jeweiligen Fachbereich abgestimmte Unterweisung in dieser interdisziplinären Strategie erleichtert Entscheidungen zum korrekten Einsatz von antibiotischen Wirkstoffen und trägt zur Reduktion der Resistenzentwicklung bei.
DDr. Christa Eder
ist Fachärztin für Pathologie und Mikrobiologin. Seit vielen Jahren schreibt sie für das österreichische Fachmagazin „Zahn.Medizin.Technik“ und die deutsche Fachzeitung „dzw – Die ZahnarztWoche“. Auch ist sie als Vortragende im Bereich der zahnärztlichen Mikrobiologie international bekannt.