Viren sind einfach aufgebaut: Sie bestehen aus ein wenig Erbgut, umhüllt von Proteinen und Lipiden. Lediglich 20 bis 200 Nanometer klein, lassen sie sich nur mit dem Elektronenmikroskop erkennen. Doch ihre Fähigkeit, lebende Zellen zu entern und sie für ihre Vermehrung zu missbrauchen, macht Viren einzigartig. Häufig zerstören sie dabei ihre Wirtszellen. Dann werden Tiere und Menschen krank – oder gesund. Prof. Susanne Bailer und ihrem Team am Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB in Stuttgart ist es gelungen, das Herpes-simplex-Virus Typ 1 gentechnisch so zu verändern, dass es als wirkungsvolle Waffe gegen Tumorzellen eingesetzt werden kann.
Das Herpesvirus ist bekannt für die schmerzenden, unansehnlichen Bläschen, die es auf der Lippe hervorruft. Vor allem bei Menschen mit geschwächter Immunabwehr können Herpesviren auch eine Hirnentzündung auslösen. Bailer, die am Fraunhofer IGB das Innovationsfeld „Virus-basierte Technologien“ leitet, ist ein Kunststück gelungen: Sie schaltete die Gene des Virus, die Krankheit verursachen, aus – und machte es damit für die Therapie nutzbar.
Virus umprogrammieren
Das Erbmaterial des Herpesvirus besteht aus DNA, nicht aus RNA wie beispielsweise beim Coronavirus SARS-CoV-2. „Das DNA-Genom ist wesentlich größer als das RNA-Genom, das heißt, es lassen sich zahlreiche zusätzliche Gene dort unterbringen. Wenn wir das Virus umprogrammieren wollen, haben wir also einen großen Speicher zur Verfügung“, erklärt Bailer, die bereits seit 20 Jahren an Herpesviren forscht.
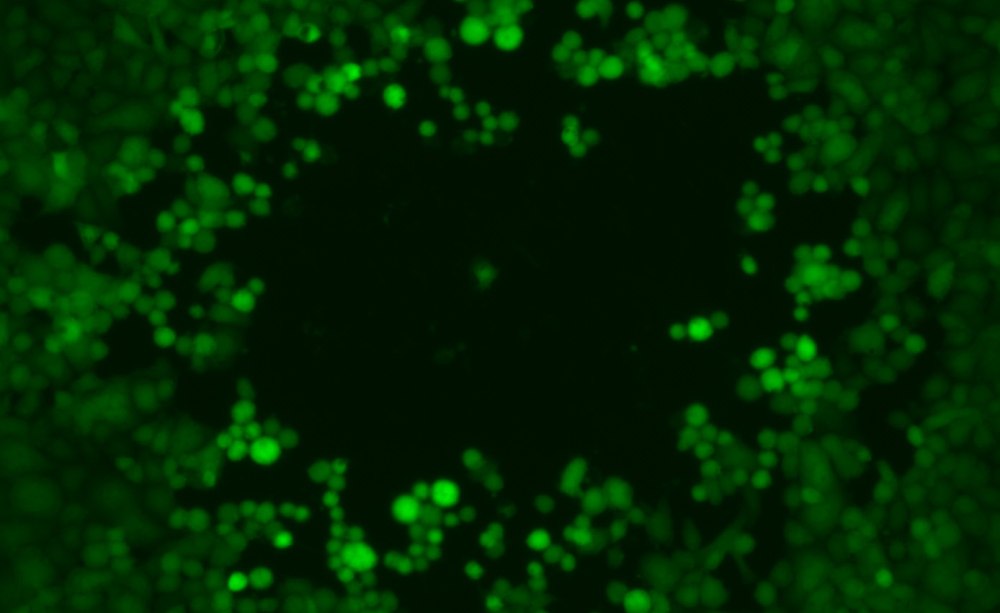
Plaquebildung von Zellkulturzellen durch einen engineerten, grün fluoreszierenden Herpes-simplex-Virus 1. Durch Vermehrung eines einzelnen Virus entsteht lokal ein Lysehof (Plaque), der an den Rändern durch noch lebende Zellen leuchtet.
Grundlegende Technologien bereits vorhanden
Ein weiterer Vorteil laut Fraunhofer IGB: Die grundlegenden Technologien, mit denen sich Herpesviren gentechnisch verändern lassen, sind bereits vorhanden. Befördert von der Corona-Impfstoffentwicklung hat die Forschung hier in den vergangenen Jahren große Fortschritte erzielt. Der AstraZeneca-Impfstoff basiert auf Adenoviren, die bei Schimpansen Erkältungen auslösen, für den Menschen aber harmlos sind. Die modifizierten Viren schleusen die nötigen Informationen für den Aufbau von Impf-Antigenen in menschliche Zellen, woraufhin SARS-CoV-2-spezifische Antikörper gebildet werden. Generell, so glaubt Bailer, habe der Erfolg von AstraZeneca die Forschung an gentechnisch veränderten Viren bestärkt und frühere Vorbehalte weitgehend ausgeräumt.
Viren dringen nur in Krebszellen ein
Bailer und ihrem Team gelang es, die gentechnischen Verfahren zur Manipulation der Herpesviren zu verbessern. So konnten sie eine Zielsteuerung einprogrammieren. „Diese sorgt dafür, dass unsere Viren, die wir direkt in den Tumor injizieren, in Krebszellen eindringen und nicht in gesunde. Dort vermehren sie sich und bringen die Zellen zum Platzen.” Dabei werden Tumormarker frei, die das körpereigene Immunsystem im Kampf gegen den Krebs in Stellung bringen. „Zusätzlich aktivieren wir die Immunabwehr mit spezifischen Proteinen, die unsere Viren bei der Reproduktion abgeben. Das Immunsystem erkennt daraufhin die Tumorzellen und eliminiert sie.« Bailer hofft, so auch unentdeckte Metastasen abseits des Tumorherdes bekämpfen zu können. „Das Immunsystem ist unsere stärkste Waffe gegen den Krebs. Mithilfe unseres Virus und den freigesetzten Tumormarkern wollen wir es zielgerichtet stimulieren, sodass der Körper sich quasi selbst therapieren kann.”

Mit einem Plaque-Assay prüfen Forschende an Zellkulturen, ob Viren infektiös sind.
Erste Erfolge gegen Lungenkrebs
Erste präklinische Tests mit dem sogenannten onkolytischen Virus führte das Team des Fraunhofer IGB im Projekt TheraVision durch, in Kooperation mit den Fraunhofer-Instituten für Zelltherapie und Immunologie IZI, für Toxikologie und Experimentelle Medizin ITEM und für Silicatforschung ISC. Die Forscherinnen und Forscher spezifizierten das Virus zur Therapie des nicht-kleinzelligen Lungenkarzinoms. Die Sterblichkeit bei dieser Krebsart ist hoch: Nur 22 Prozent aller Patientinnen und 17 Prozent aller Patienten überleben die ersten fünf Jahre nach der Diagnose Lungenkrebs, beim nicht-kleinzelligen Karzinom ist die Prognose wegen seiner frühen Metastasenbildung noch schlechter.
Virus-Immuntherapie könnte auch bei Metastasen anschlagen
Die Ergebnisse der Studien sind vielversprechend. Die Tumorzellen wurden zuverlässig zerstört, auch bei Metastasen scheint die Virus-Immuntherapie anzuschlagen. „Das müssen wir allerdings noch weiter untersuchen”, räumt Bailer ein. Noch ist es für eine klinische Erprobung zu früh. Die Voraussetzungen dafür sind jedoch gut, denn das Herpes-simplex-Virus bietet gegenüber anderen Viren einen weiteren entscheidenden Vorteil: Es gibt eine Art „Notbremse”. Wenn es bei der Therapie von geschwächten Krebspatientinnen und -patienten zu unvorhergesehenen Nebenwirkungen kommen sollte, lässt sich die Vermehrung der Viren zuverlässig mit einem seit fast 50 Jahren erprobten, äußerst wirksamen Virostatikum stoppen.
Vor dem Einsatz in der Klinik sind aber weitere Studien notwendig: „Wir müssen die Wirkmechanismen besser verstehen, um das volle Potenzial der Virus-Immuntherapie zu heben. In jedem Fall haben wir jetzt eine Virusplattform-Technologie entwickelt, die zukünftig auch für andere Tumorarten eingesetzt werden kann.”
Titelfoto: Fraunhofer IGB